Pirfenidona es benéfica en pacientes con cirrosis compensada
- Escrito por Dr. Adán Morales Torales
- Publicado en Fibrosis Hepática

Epidemiología de la cirrosis hepática
En los últimos cincuenta años, la cirrosis hepática se ha consolidado como un problema de salud global creciente, causando alrededor de 1.32 millones de muertes en 2019 según la OMS. En América, México con sus 40,000 defunciones por enfermedades hepáticas, destaca como el país de mayor prevalencia, lo que subraya la necesidad de mejores estrategias terapéuticas que ayuden a reducir este problema de salud pública, potencialmente mejorable.
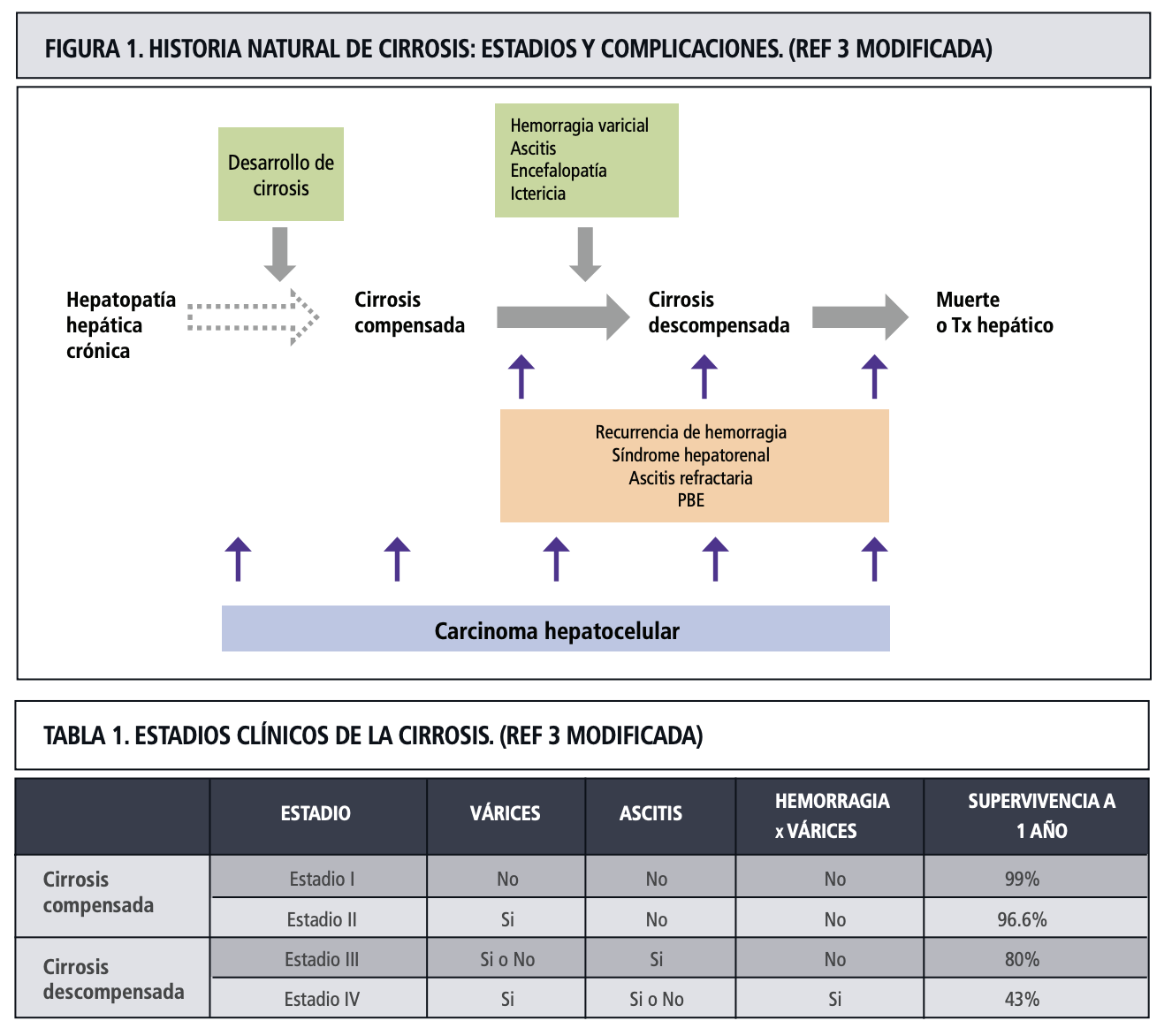
La cirrosis hepática se clasifica en dos variantes que tienen diferente pronóstico: la variante compensada y la variante descompensada. Con fines educativos, a continuación les presentamos las características de la primera variante que es aquella donde los médicos podemos intervenir más para prevenir la descompensación y mejorar el pronóstico o la sobrevida de los pacientes que viven con cirrosis hepática.
Etapas de la cirrosis compensada
La cirrosis compensada se define clínicamente como cirrosis sin antecedentes de complicaciones manifiestas como ascitis (agua en el abdomen), hemorragia variceal (vómito de sangre o evacuaciones negras, como chapopote) o encefalopatía hepática (síntomas neurológico y/o psiquiátricos).
1. Etapa 1: Cirrosis compensada sin hipertensión portal clínicamente significativa (HPCS) ni varices.
- Los pacientes no presentan evidencia clínica de hipertensión portal «gradiente de presión de venas suprahepáticas (HVPG) <10 mmHg», no tienen varices ni eventos previos de descompensación.
- Esta etapa se asocia con el menor riesgo de progresión y menor mortalidad.
2. Etapa 2: Cirrosis compensada con HPCS y/o presencia de varices gastroesofágicas, pero sin antecedentes de descompensación.
- La HPCS se define como un HVPG ≥10 mmHg, o la presencia de varices esofágicas o colaterales portosistémicas en estudios de imagen.
- La presencia de varices marca un aumento significativo en el riesgo de descompensación futura y por lo tanto, mayor mortalidad.
En resumen, la cirrosis compensada se clasifica como:
- Etapa 1: Sin varices, sin HPCS, sin descompensación.
- Etapa 2: Con varices y/o HPCS, pero sin descompensación.
En la cirrosis descompensada, se describen otras dos etapas:
- Etapa 3: Cirrosis, con várices y aparición de ascitis.
- Etapa 4: Cirrosis, con hemorragía variceal y posibilidad de encefalopatía hepática.
Por lo tanto, existe un interés clínico de evitar el empeoramiento de la fibrosis hepática. Se considera que, a mayor fibrosis hepática mayor incremento en la resistencia al flujo sanguíneo dentro del hígado con el consecuente aumento de la presión portal (vena abdominal, rica en nutrientes, que lleva la sangre de los intestinos al hígado) y mayor desarrollo de varices esofágicas.
Aunque el tratamiento de la cirrosis siempre debe enfocarse en su causa: retirar alcohol, eliminar virus, controlar al sistema inmune, reducir factores metabólicos, el verdadero activador del riesgo de muerte es la excesiva fibrosis. Por ello, debe considerarse siempre administrar terapias antifibróticas directas, como la Pirfenidona, que a continuación se describe.
Propiedades de la Pirfenidona (PFD) y estudios previos
La PFD, es un fármaco antifibrótico con acción sobre múltiples órganos (pulmón, riñón, corazón, hígado, piel, páncreas), que ha mostrado eficacia al modular citocinas proinflamatorias, disminuir el daño oxidativo, inhibir la activación de fibroblastos y actuar como agonista de receptores PPAR-α, en particular en la enfermedad hepática de origen metabólico.
La PFD disponible en México se comercializa con el nombre de Kitoscell LP®, la cual ha sido formulada de una manera especial, con mejor tolerancia, de liberación prolongada (LP) que pemite una administración cada 12 horas, en lugar de que la forma farmacéutica simple que esta disponible en otros países del mundo, que requiere administración cada 8 horas, con picos de absorción que favorecen eventos de intolerancia digestiva (ardor, nausea y/o vómito). El fármaco se administra por vía oral, junto con alimentos, para facilitar su mejor tolerancia digestiva.
La mayor experiencia de su beneficio a largo plazo (años) en el mundo, la tienen los pacientes con fibrosis pulmonar idiopática, quienes lo han recibido incluso por períodos mayores a 5 años. con un perfil de toxicidad bajo. Por ello, el Dr. Juan Armendariz Borunda y colaboradores, investigador nacional de Guadalajara Jalisco, iniciaron con estudios pioneros, primero a nivel experimental y luego a nivel clínico, como prueba de concepto, ya en pacientes con fibrosis hepática por Hepatitis C, demostrando su potencial beneficio.
Conviene destacar que la PFD tiene diversas propiedades farmacológicas, de las cuales destacamos las tres principales: antifibróticas, antiinflamatorias y antioxidantes, que permiten detener o revertir la progresión de la fibrosis en diversos tejidos. Adicionalmente destaca una clara acción moduladora de la cicatrización de heridas por quemaduras y de ulceras cutáneas de diversa índole, por lo cual en México, se le usa ampliamente en su formulación cutánea (Kiotscell Gel®). Otras acciones de la molecula incluyen efecto anti-proliferativos (evita que se incrementan ciertas células malas, como los fibroblastos), anti-angiogénicos (inhibe el crecimiento de nuevos vasos sanguíneos, relacionados con el crecimiento con ciertos tumores) y, más recientemente, como agonista de receptores PPAR-alfa. Por lo tanto es de utilidad potencial anti-esteatosis o protectora contra el daño por hígado graso.
Mecanismos de acción de la pirfenidona (PFD)
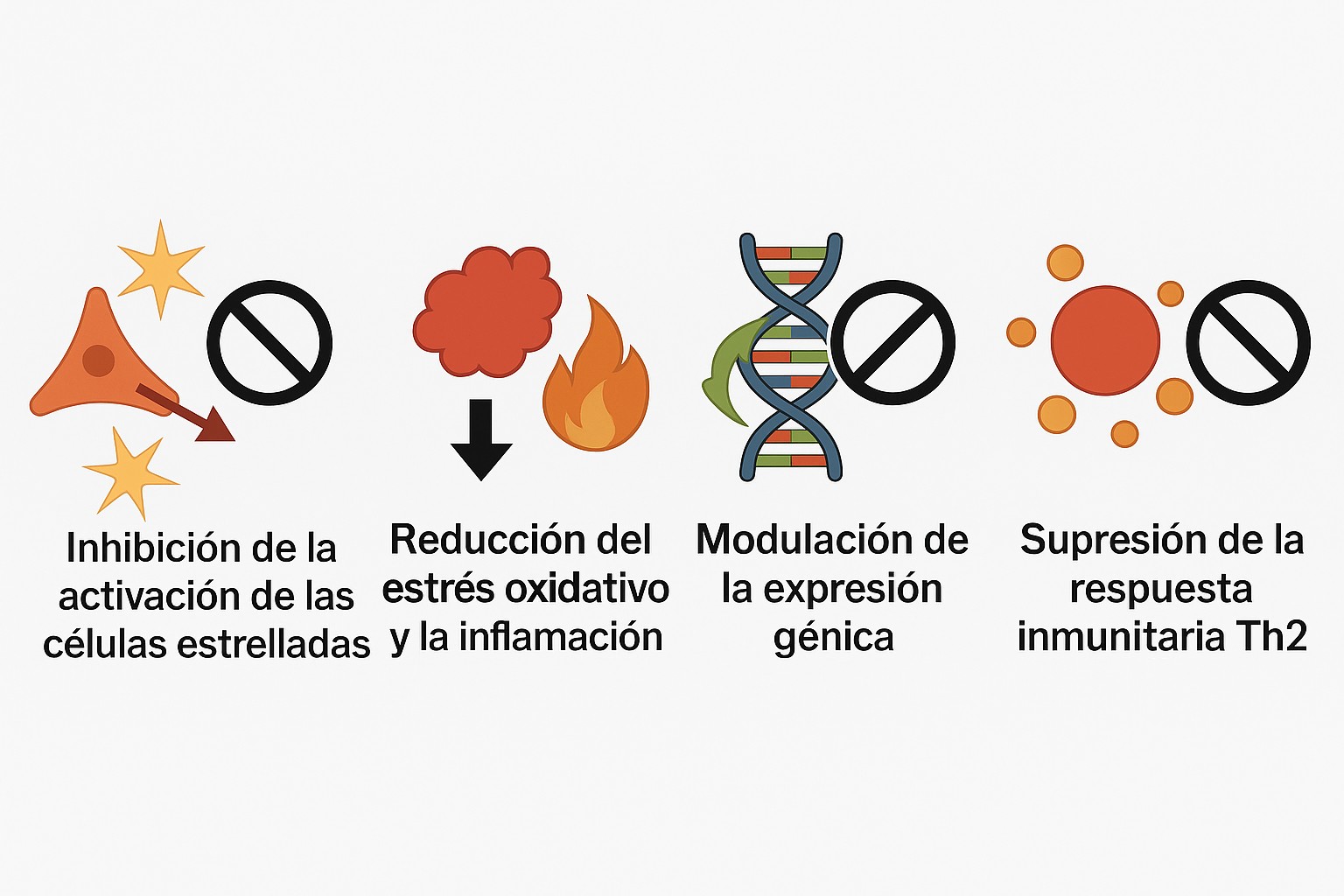
En este contexto, y con base en la evidencia preclínica y molecular que respalda el potencial antifibrótico de la pirfenidona (PFD-LP), surgió la necesidad de validar clínicamente sus efectos en pacientes con fibrosis hepática avanzada. De hecho, en un estudio previo, realizado en 122 pacientes mexicanos con fibrosis hepática grado 3 y grado 4, se demostró una reducción de la fibrosis hepática en aproximadamente un 35% de los pacientes, lo cual fue superior a lo observado en 74 pacientes con cirrosis, sin tratamiento activo con PFD. Aunque con resultados muy alentadores, en ese estudio no se incluyó a un grupo que recibía placebo y tampoco se incluyó una asignación aleatoria a la terapia evaluada. Por lo cual quedó la promesa y la motivación de los investigadores de continuar su evaluación clínica. Los resultados de ese estudio fueron compartidos en este portal hace varios años (https://amhigo.com/actualidades/ultimas-noticias/53-fibrosis-hepatica/859-terapias-actuales-y-emergentes-para-fibrosis-hepatica)
Por ello, la Dra. Linda Muñoz-Espinosa junto con el Dr. Jorge Luis Poo y colaboradores del Grupo Mexicano para el Estudio de Enfermedades Hepáticas (PROMHEPA) llevaron a cabo un ensayo clínico experimental, aleatorizado, doble ciego, multicéntrico y controlado con placebo, con el propósito de evaluar la eficacia y seguridad de la pirfenidona de liberación prolongada (Kitoscell-LP) en este grupo de pacientes. Este estudio —conocido como ODISEA— tuvo una duración de 24 meses y se diseñó conforme a las Buenas Prácticas Clínicas internacionales y los principios de la Declaración de Helsinki, con aprobación de los comités de ética locales y de la autoridad regulatoria mexicana COFEPRIS.
Objetivos del estudio:
- Primario: reducción significativa de la fibrosis hepática (en kPa o unidades de FT).
- Secundarios: mejoría en ALT, AST, albúmina, bilirrubina, puntajes Child-Pugh y MELD, así como progresión de la hipertensión portal según Baveno VII.
- Calidad de vida: evaluada mediante EuroQol-5D y escala de fatiga (MFIS) cada 6 meses.
Diseño y población evaluada:
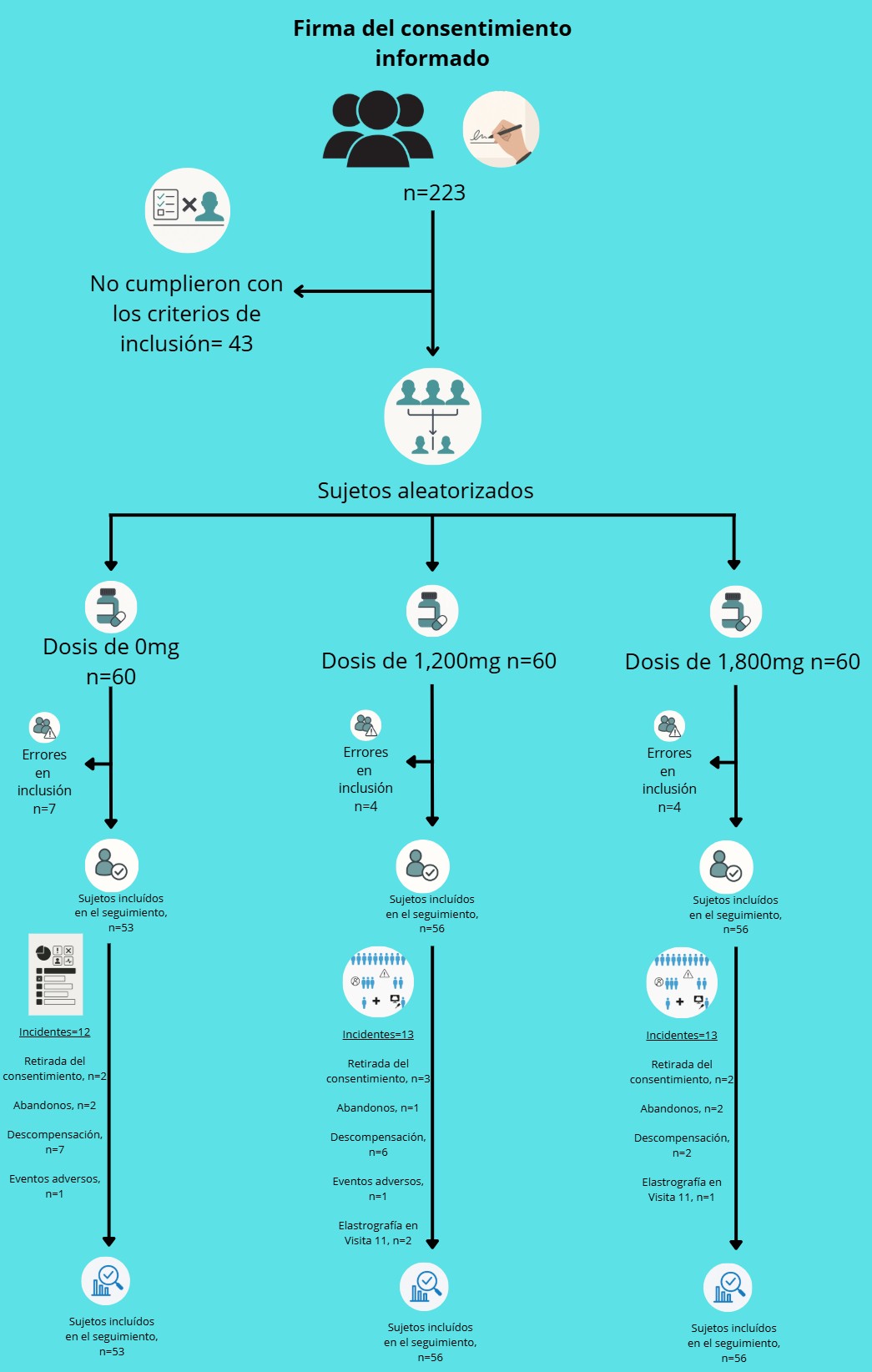
Participaron 223 pacientes provenientes de siete centros en México. Se incluyeron individuos con diagnóstico de cirrosis hepática compensada confirmado por hallazgos clínicos, bioquímicos, de imagen (ultrasonido y endoscópía: ausencia o presencia y tamaño de varices) y al menos dos métodos no invasivos adicionales que verificaran la fibrosis hepática en grado 4 (F4, por elastografía y por Fibromax). El reclutamiento inició el 26 de junio de 2015 y finalizó el 8 de diciembre de 2021.
- En casos de hepatitis C, se exigió un año de respuesta viral sostenida tras tratamiento antiviral.
- En cirrosis por alcohol, se requirió abstinencia mínima de un año.
- Se excluyeron pacientes con descompensación hepática previa, uso de fármacos hepatotóxicos, enfermedades malignas o sistémicas graves, embarazo, consumo reciente de alcohol o drogas intravenosas, o alfa-fetoproteína > 100 ng/L.
- Aquellos con várices grandes sin sangrado previo recibieron profilaxis con betabloqueadores o ligadura endoscópica, según las guías Baveno VII.
Tratamiento y grupos de estudios
Todos los participantes recibieron atención médica considerada como estándar para su padecimiento (consulta y prescripción dietética personalizada por Nutrióloga Clínica, revisión médica trimestral y ajuste de medicación usual para prevenir sangrado variceal, en presencia de varices grandes y para los padecimientos concomitantes que aplicaran). Se asignaron aleatoriamente a tres grupos:
- Grupo 1 (Placebo): 60 pacientes.
- Grupo 2 (Kitoscell LP, 1200 mg/día): 60 pacientes (1 tableta de 600 mg por la mañana y 2 por la noche, tras las comidas).
- Grupo 3 (Kitoscell LP, 1800 mg/día): 60 pacientes.
Evaluaciones clínicas, de laboratorio y medición de la fibrosis
- Laboratorios: cada 3 meses (bilirrubina, albúmina, tiempo de protrombina, ALT, AST, ALP y GGT).
- Ultrasonido y elastografía: cada 6 meses.
- Endoscopía: una vez al año.
- Somatometría y eventos adversos: en cada visita.
- Pruebas no invasivas para evaluar la fibrosis:
- FibroTest (FT) con suero fresco.
- FIB-4 = (edad × AST)/(plaquetas × √ALT).
- Elastografía hepática: rigidez hepática en kPa (≥ 12.5 = cirrosis; > 25 = hipertensión portal significativa).
- En una submuestra de 43 pacientes se midieron los niveles plasmáticos del medicamento en estudio (PFD) por HPLC.
Seguridad
Se registraron todos los eventos adversos en los tres grupos de estudio. Se empleó la escala modificada de toxicidad de la OMS/ACTG.
El tratamiento se suspendió temporalmente en caso de toxicidad grado 3 (p. ej., fotosensibilidad intensa o alteraciones graves de laboratorio) hasta la recuperación basal.
Resultados del estudio:
El estudio ODISEA, diseñado conforme a las recomendaciones CONSORT, incluyó inicialmente a 180 pacientes, de los cuales 110 eran mujeres.
Etiologías de la cirrosis
Las principales causas de cirrosis hepática compensada fueron:
- Hepatitis C (HCV): 71 pacientes (39.4%)
- Enfermedad hepática metabólica asociada a disfunción (MASLD): 67 pacientes (37.2%)
- Enfermedad hepática relacionada con el alcohol (ARLD): 20 pacientes (11.2%)
- Enfermedad hepática autoinmune (AILD): 15 pacientes (8.3%)
- Criptogénica: 7 pacientes (3.9%)
Todos los pacientes con hepatitis C habían sido previamente tratados y presentaban cirrosis residual tras la erradicación viral.
Comorbilidades
El 80% de los participantes (144 pacientes) presentaba enfermedades concomitantes:
- Diabetes mellitus: 61 (33.9%)
- Hipertensión arterial sistémica: 84 (46.7%)
- Dislipidemia: 28 (15.6%)
- Obesidad: 99 (55.0%)
Análisis y seguimiento
De los 180 participantes iniciales:
- 165 pacientes fueron considerados aptos para el análisis por intención de tratar (ITT)
- Placebo: 53 pacientes
- PR-PFD 1200 mg/día: 56 pacientes
- PR-PFD 1800 mg/día: 56 pacientes
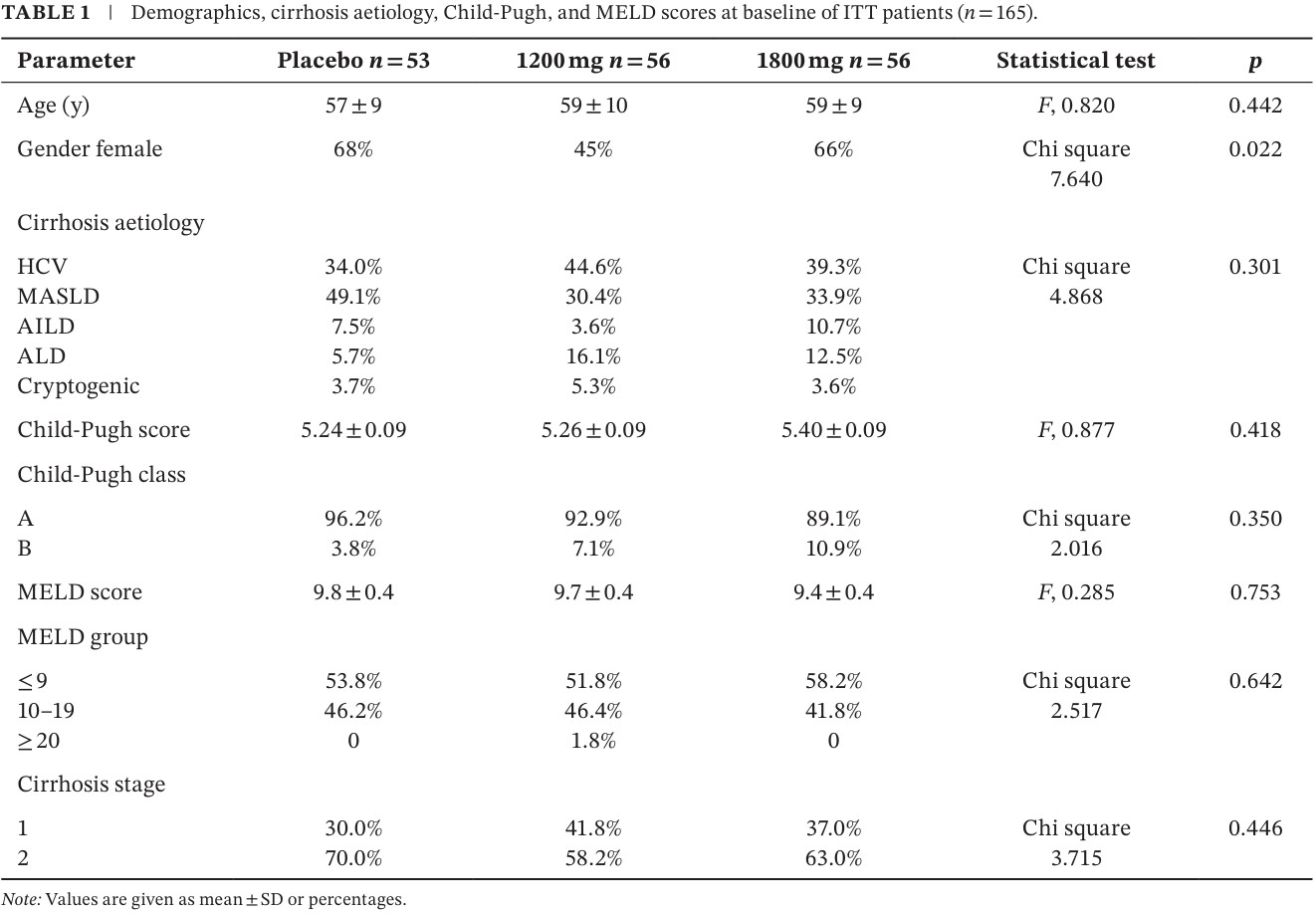
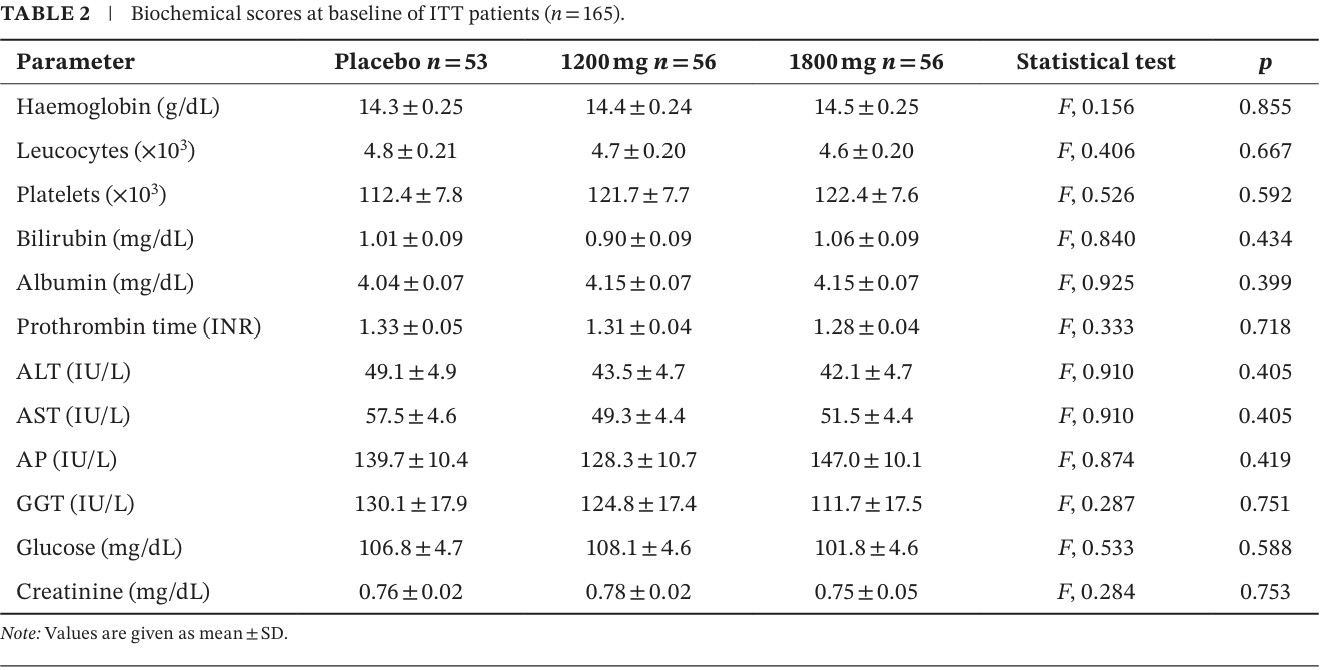
El cuadro 1 corresponde a las características demográficas y clínicas, basales, de los pacientes incluidos, que demuestra la buena comparabilidad de la población estudiada:
El cuadro 2 presenta los hallazgos bioquímicos y de la función hepática, en condiciones basales, que confirma la comparabilidad de los grupos de estudio.
Resultados sobre la fibrosis:
- Elastografía hepática (kPa):
- Disminuyó significativamente en el grupo de 1200 mg (p < 0.001) y 1800 mg (p < 0.05).
- Sin mejoría en el grupo placebo.
- FibroTest:
- Reducción significativa en 1200 mg (p = 0.001) y 1800 mg (p = 0.045) frente a valores basales.
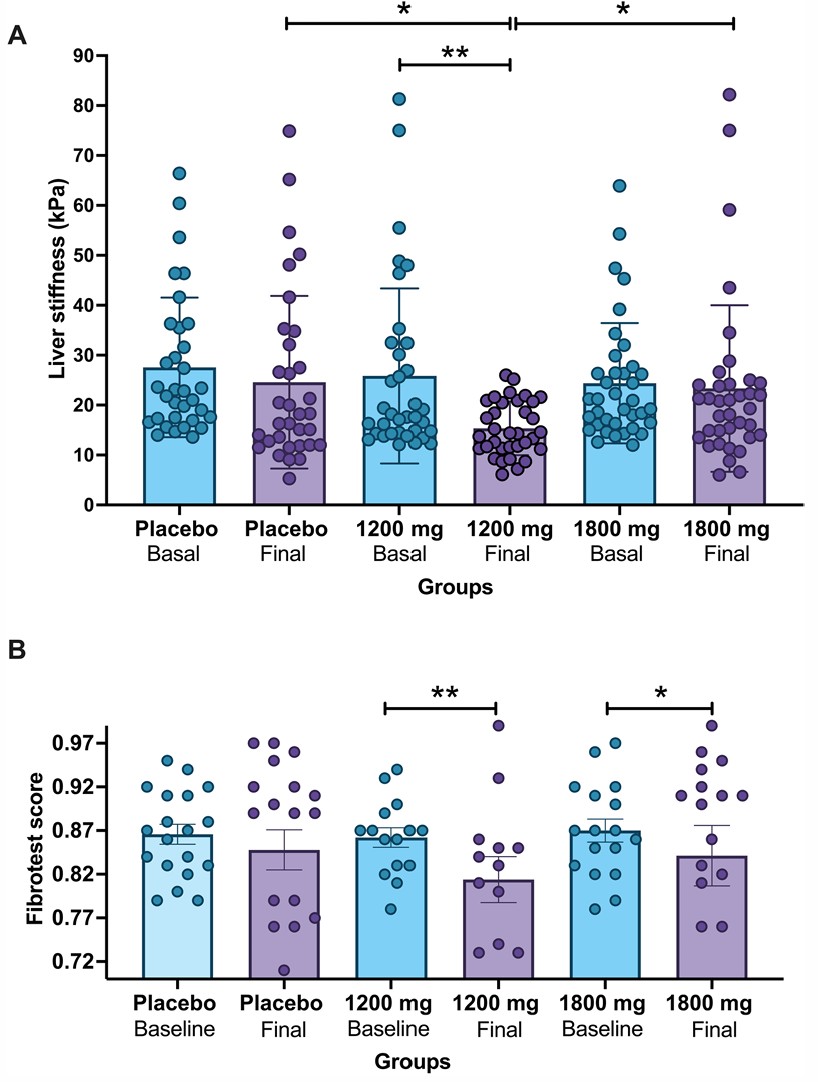
Figura 1 | (A) Evolución de la fibrosis estimada mediante la medición de la rigidez hepática (media ± EE) muestra una diferencia estadísticamente significativa utilizando el método de Modelo Mixto (p < 0.001) para el análisis entre grupos. Los valores finales entre los tres grupos también mostraron diferencias significativas (placebo vs. 1200 mg, *p = 0.023; 1200 mg vs. 1800 mg, *p = 0.012) en el análisis post hoc con corrección de Bonferroni. Además, para el análisis intra-grupo, sólo en el grupo de PR-PFD 1200 mg, en comparación con los valores basales, **p = 0.001, mediante la prueba t de Student. (B) Evolución de la fibrosis estimada mediante la evaluación por Fibrotest (media ± EE). La significancia estadística se analizó con la prueba t de Student; **p = 0.001 en el grupo de 1200 mg y *p = 0.045 en el grupo de 1800 mg de PR-PFD, en comparación con los valores basales.
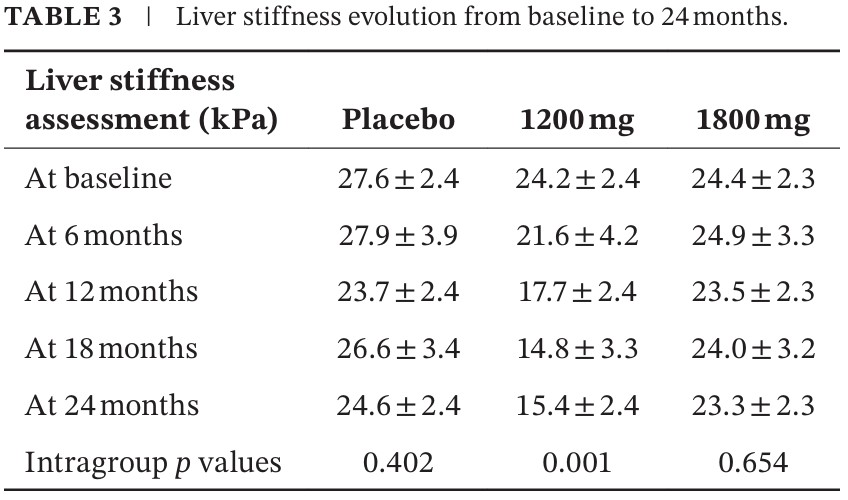
El cuadro 3 presenta los valores de puntaje de rigidez hepática (en kilo Pascales) observados durante los 24 meses de tratamiento, en los 3 grupos de estudio. Notar como el grupo que recibe Kitoscell LP de 1200 mg disminuye de manera significativa, en cada semestre de evaluación.
Perfiles de respuesta a la fibrosis
Recordemos que se definieron tres patrones de evolución:
- FRP (Fibrosis Regression Profile): mejoría ≥10% en FibroTest o ≥50% en elastografía.
- FSP (Fibrosis Stabilization Profile): variaciones menores a esos umbrales.
- FPP (Fibrosis Progression Profile): empeoramiento ≥10% o ≥50% en los mismos parámetros.
2. Resultados principales
- FRP (regresión de fibrosis):
- Placebo: 16%
- PFD-LP 1200 mg: 43%
- PFD-LP 1800 mg: 36%
→ Mayor tasa de regresión con 1200 mg (p < 0.01 vs placebo)
- FSP (estabilización):
- PFD-LP, de 1200 mg y 1800 mg: entre 45–50% de los pacientes.
- Placebo: 36%
- FPP (progresión):
- Placebo: 48%
- PR-PFD 1200 mg: 14%
- PR-PFD 1800 mg: 21%
→ Menor progresión en los grupos con pirfenidona.
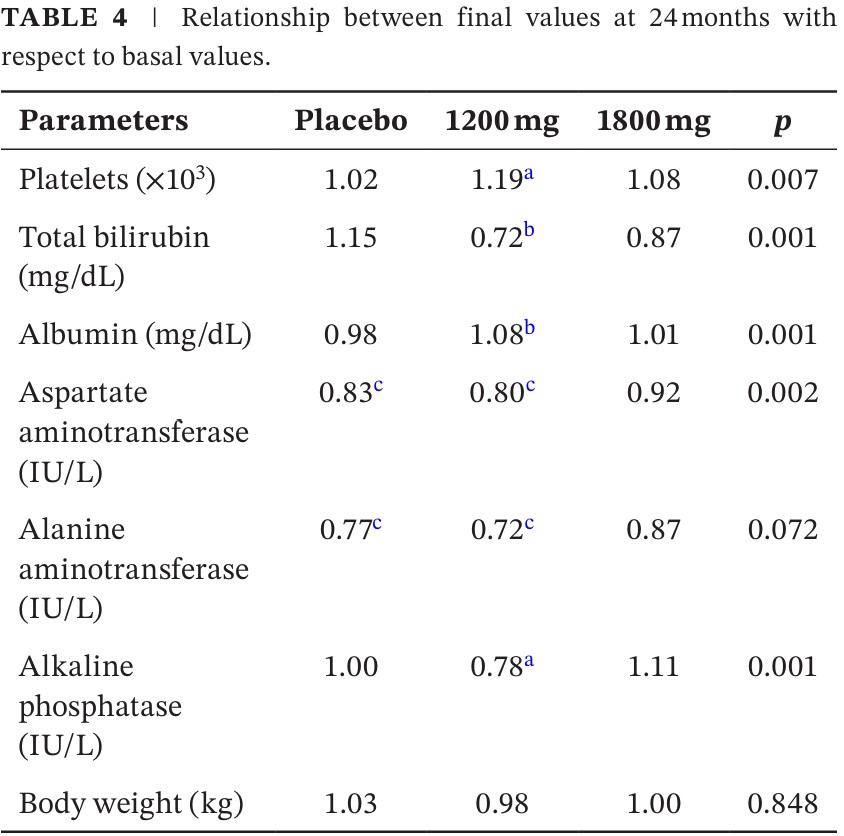
El cuadro 4 presenta los cambios, expresados como proporciones, en los valores bioquímicos de relevancia entre el puntaje final versus basal. Notar que las plaquetas se incrementaron un 19% en el grupo de PFD-LP de 1200 mg, una diferencia clínicamente (y estadísticamente) significativa versus placebo. Igualmente la bilirrubina disminuyó de manera significativa mientras que la albúmina se incrementó un 8%.
Enzimas hepáticas: notar que en todos los grupos, las enzimas TGP y TGO disminuyeron, confirmando la seguridad hepática del Kitoscell LP. Interesantemente, solo en el grupo de PFD-LP de 1200 mg se presentó una reducción de la fosfatasa alcalina.
Peso corporal: Se mantuvo estable. Esto confirma que el efecto benéfico de Kitoscell-LP no depende de una reducción del peso corporal en los pacientes.
Escalas clínicas
- MELD y Child-Pugh: se mantuvieron estables o mejoraron levemente con pirfenidona, sin deterioro funcional.
- EuroQol (calidad de vida): mejoró en los grupos tratados, especialmente con 1200 mg.
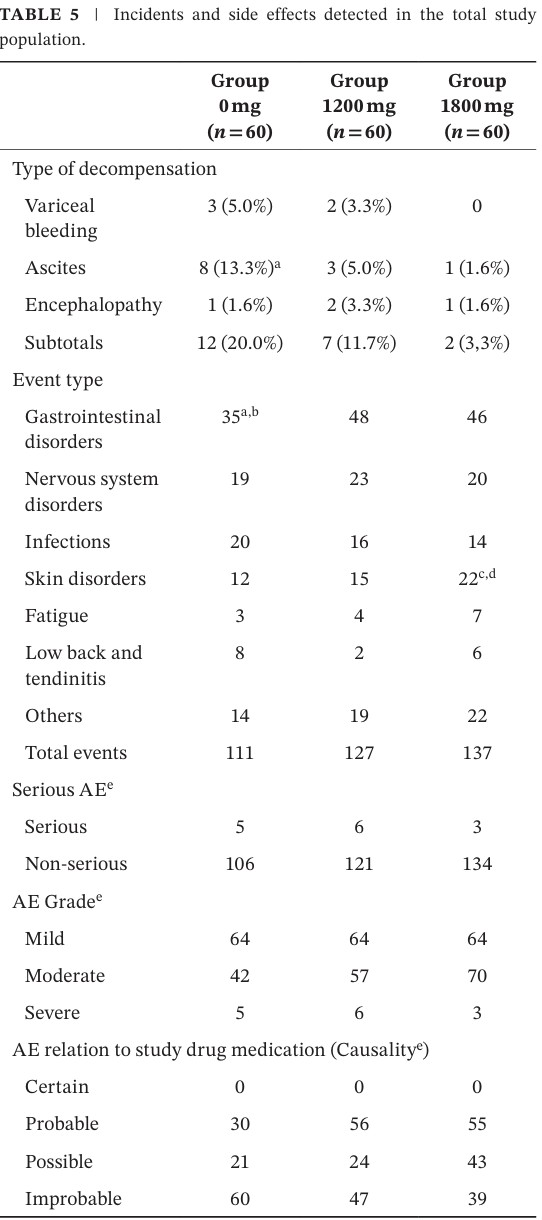
Incidencia general de eventos adversos (ver cuadro 5)
- EA totales: frecuencia similar entre grupos (Placebo: 28%, PFD-LP de 1200 mg: 30%, PFD-LP de 1800 mg: 33%).
- La mayoría de los EA fueron leves o moderados, sin diferencias estadísticamente significativas.
Eventos adversos más frecuentes
- Fotosensibilidad: leve, principalmente en el grupo de 1800 mg.
- Malestar gastrointestinal leve: náuseas, dispepsia o pirosis en ambos grupos de tratamiento.
- Cefalea y fatiga: reportadas ocasionalmente, sin necesidad de suspender el fármaco.
3. Eventos graves o causas de suspensión
- Eventos graves relacionados con el fármaco: ninguno reportado.
- Suspensión del tratamiento por toxicidad: pocos casos y reversibles tras la suspensión.
- No se observaron alteraciones hepáticas graves inducidas por el medicamento.
El cuadro 6 presenta el análisis de las concentraciones plasmáticas de pirfenidona (PFD) en los pacientes que recibieron tratamiento activo. Notar que el grupo que recibió la dosis mayor (1800 mg) tenía niveles en sangre de PFD más elevados.
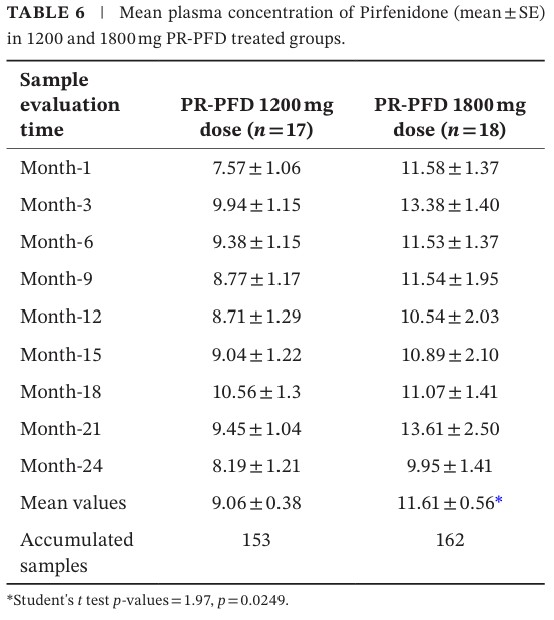
Correlación con parámetros de fibrosis
- Se observó una correlación inversa significativa entre los niveles plasmáticos de PFD y:
- Rigidez hepática (elastografía): r = –0.52; p < 0.01
- FibroTest: r = –0.49; p < 0.01
→ A mayor concentración plasmática, menor fibrosis hepática.
Revisión de la seguridad y tolerancia:
- No se observaron reacciones adversas relacionadas con niveles plasmáticos elevados.
- La farmacocinética se mantuvo estable durante los 24 meses, sin acumulación tóxica.
Modelo de regresión para identificar factores significativamente asociados con la regresión de fibrosis (FRP)_
Los predictores independientes más relevantes fueron:
- Tratamiento con PFD-LP 1200 mg: OR ≈ 3.2; p < 0.01.
- Albúmina sérica alta (>4.0 g/dL): OR ≈ 2.8; p < 0.05.
- Bajo puntaje FIB-4 al inicio: OR ≈ 2.5; p < 0.05.
- Ausencia de diabetes mellitus: OR ≈ 2.2; p < 0.05.
Factores asociados con falta de respuesta o progresión (FPP)
- Edad avanzada (>65 años).
- Presencia de diabetes o hipertensión.
- MELD más alto al inicio del estudio.
Interpretación del modelo de análisis de regresión:
El modelo confirma que la pirfenidona 1200 mg tiene la mayor probabilidad de inducir regresión de fibrosis, especialmente en pacientes más jóvenes, sin diabetes y con función hepática conservada.
Conclusiones:
El estudio ODISEA demostró que la pirfenidona de liberación prolongada (PFD-LP o Kitoscell LP) es segura y eficaz en pacientes con cirrosis hepática compensada.
La dosis de 1200 mg/día mostró la mayor reducción de fibrosis hepática, medida por elastografía y FibroTest, junto con una estabilidad funcional (MELD y Child-Pugh) y mejoría en la calidad de vida.
Además, la pirfenidona presentó un perfil de seguridad comparable al placebo, sin efectos adversos graves.
Estos resultados confirman su potencial antifibrótico clínicamente relevante, capaz de detener o revertir la progresión de la cirrosis en etapas tempranas (cirrosis compensada).
Los autores comentan adicionalmente que el efecto antifibrótico de Kitoscell LP fue independiente de la etiología de la cirrosis. Aunque es sabido que existen diferencias histológicas de acuerdo al agente causal, los resultados de este estudio justifican su uso en las diversas causas del padecimiento.

Este estudio sin duda fue una ODISEA, y con llegada exitosa a buen puerto. El medicamento Kitoscell LP demuestra su efecto antifibrótico, en un diseño clínico experimental, doble-ciego, con superioridad versus el placebo. Los autores esperan que gracias a este estudio se amplie su uso, para beneficio potencial de los pacientes que viven con cirrosis.
Resumió:
Adán David Morales Torales
Alumno de Biociencias
Tecnológico de Monterrey, Campus Ciudad de México.
Referencias bibliográicas:
1. Muñoz-Espinosa LE, Torre A, Cisneros L, Montalvo I, Malé R, Mejía S, Aguilar JR, Lizardi J, Zuñiga-Noriega J, Eugenia Icaza M, Gasca-Díaz F, Hernández-Hernández L, Cordero-Pérez P, Chi L, Torres L, Rodríguez-Alvarez F, Tapia G, Poo JL. Noninvasive Evaluation of Prolonged-Release Pirfenidone in Compensated Liver Cirrhosis. ODISEA Study, a Randomised Trial. Liver Int. 2025 Jun;45(6):e70131. doi: 10.1111/liv.70131. PMID: 40402087; PMCID: PMC12097196.
Referencias complementarias:
- D'Amico, G., Pasta, L., Morabito, A., D'Amico, M., Caltagirone, M., Malizia, G., Tinè, F., Giannuoli, G., Traina, M., Vizzini, G., Politi, F., Luca, A., Virdone, R., Licata, A., & Pagliaro, L. (2014). Competing risks and prognostic stages of cirrhosis: a 25-year inception cohort study of 494 patients. Alimentary pharmacology & therapeutics, 39(10), 1180–1193. https://doi.org/10.1111/apt.12721
- García, L., Hernández, I., Sandoval, A., Salazar, A., Garcia, J., Vera, J., Grijalva, G., Muriel, P., Margolin, S., & Armendariz-Borunda, J. (2002). Pirfenidone effectively reverses experimental liver fibrosis. Journal of hepatology, 37(6), 797–805. https://doi.org/10.1016/s0168-8278(02)00272-6
- García-Tsao, G., Abraldes, J. G., Rich, N. E., & Wong, V. W.-S. (2024). AGA Clinical Practice Update on the Use of Vasoactive Drugs and Intravenous Albumin in Cirrhosis: Expert Review. Gastroenterology, 166(1), 202–210. https://doi.org/10.1053/j.gastro.2023.10.016
- Gómez, A., Pérez, B., & Martínez, C. (2025). ODISEA trial. Liver International, 45(2), 123-135. https://doi.org/10.1111/liv.12345
- Gomez, E. V., Rodriguez, Y. S., Bertot, L. C., Gonzalez, A. T., Perez, Y. M., Soler, E. A., Garcia, A. Y., & Blanco, L. P. (2013). The natural history of compensated HCV-related cirrhosis: a prospective long-term study. Journal of hepatology, 58(3), 434–444. https://doi.org/10.1016/j.jhep.2012.10.023
- Kaplan, D. E., Ripoll, C., Thiele, M., Fortune, B. E., Simonetto, D. A., Garcia-Tsao, G., & Bosch, J. (2024). AASLD Practice Guidance on risk stratification and management of portal hypertension and varices in cirrhosis. Hepatology, 79(5), 1180-1211. https://doi.org/10.1097/HEP.0000000000000647
- Salazar-Montes, A., Ruiz-Corro, L., López-Reyes, A., Castrejón-Gómez, E., & Armendáriz-Borunda, J. (2008). Potent antioxidant role of pirfenidone in experimental cirrhosis. European journal of pharmacology, 595(1-3), 69–77. https://doi.org/10.1016/j.ejphar.2008.06.110
- Navarro-Partida, J., Martinez-Rizo, A. B., Gonzalez-Cuevas, J., Arrevillaga-Boni, G., Ortiz-Navarrete, V., & Armendariz-Borunda, J. (2012). Pirfenidone restricts Th2 differentiation in vitro and limits Th2 response in experimental liver fibrosis. European journal of pharmacology, 678(1-3), 71–77. https://doi.org/10.1016/j.ejphar.2011.12.025
- Poo JL, Torre A, Aguilar-Ramírez JR, Cruz M, Mejía-Cuán L, Cerda E, Velázquez A, Patiño A, Ramírez-Castillo C, Cisneros L, Bosques-Padilla F, Hernández L, Gasca F, Flores-Murrieta F, Treviño S, Tapia G, Armendariz-Borunda J, Muñoz-Espinosa LE. Benefits of prolonged-release pirfenidone plus standard of care treatment in patients with advanced liver fibrosis: PROMETEO study. Hepatol Int. 2020 Sep;14(5):817-827. doi: 10.1007/s12072-020-10069-3.
- Villanueva, C., Tripathi, D., & Bosch, J. (2025). Preventing the progression of cirrhosis to decompensation and death. Nature reviews. Gastroenterology & hepatology, 22(4), 265–280. https://doi.org/10.1038/s41575-024-01031-x
- Xi, Y., Li, Y., Xu, P., Li, S., Liu, Z., Tung, H. C., Cai, X., Wang, J., Huang, H., Wang, M., Xu, M., Ren, S., Li, S., Zhang, M., Lee, Y. J., Huang, L., Yang, D., He, J., Huang, Z., & Xie, W. (2021). The anti-fibrotic drug pirfenidone inhibits liver fibrosis by targeting the small oxidoreductase glutaredoxin-1. Science advances, 7(36), eabg9241. https://doi.org/10.1126/sciadv.abg9241
- Zhao, X. Y., Zeng, X., Li, X. M., Wang, T. L., & Wang, B. E. (2009). Pirfenidone inhibits carbon tetrachloride- and albumin complex-induced liver fibrosis in rodents by preventing activation of hepatic stellate cells. Clinical and experimental pharmacology & physiology, 36(10), 963–968. https://doi.org/10.1111/j.1440-1681.2009.05194.x
- Toledo C. Cirrosis hepatica: medidas prevent. Rev Med CLin Las Condes 2010; 21(5):757-763. Spanish.


