Medicamentos
 Como regla general, los pacientes con una disfunción hepática leve o moderada pueden tomar las medicaciones prescritas habitualmente en el resto de las personas sanas. Sin embargo, a medida que la función hepática empeora, la susceptibilidad a padecer efectos adversos aumenta debido a cambios en la farmacocinética.
Como regla general, los pacientes con una disfunción hepática leve o moderada pueden tomar las medicaciones prescritas habitualmente en el resto de las personas sanas. Sin embargo, a medida que la función hepática empeora, la susceptibilidad a padecer efectos adversos aumenta debido a cambios en la farmacocinética.
Un problema de creciente interés es el manejo del dolor en la cirrosis hepática. Algunas recomendaciones deben llevarse a cabo en este contexto. El paracetamol sigue siendo el fármaco de elección en primera instancia.19 Debe considerarse, no obstante, que, en el enfermo con alcoholismo activo, el riesgo de hepatotoxicidad por paracetamol aumenta considerablemente, debiendo limitarse a un máximo de 2 g/día. El uso de AINE va asociado a un riesgo incrementado de hemorragia por varices, insuficiencia renal y resistencia al tratamiento diurético en el enfermo con ascitis. El consumo de inhibidores de la COX-2 implica menos riesgo de estos efectos adversos, pero incrementa el riesgo de accidentes cardiovasculares. Se carece de experiencia contrastada de su utilización en el enfermo con cirrosis por lo que su recomendación no puede ser sustentada en evidencias. Los opiáceos deben ser utilizados con precaución en el enfermo con cirrosis hepática. Tanto el fentanilo (frecuentemente utilizado como sedoanalgesia en endoscopia), como la metadona, parecen seguros. La morfina puede ser utilizada a dosis más reducidas y en intervalos más prolongados. La codeína y el tramadol pueden tener efectos impredecibles, por lo que no pueden recomendarse, debiendo recurrir a otras alternativas.20
Profilaxis de infecciones
En los enfermos con cirrosis hepática debería conocerse su estado de inmunización frente a los virus de las hepatitis A y B y, en su caso, proceder a la vacunación frente a éstos, dado que la exacerbación del daño necroinflamatorio que produce la infección aguda puede tener consecuencias fatales en un enfermo con una cirrosis subyacente. Igualmente debe considerarse la vacunación contra el neumococo y anualmente contra el virus de la influenza.17, 19
Manejo específico de la cirrosis hepática de acuerdo a la etiología.
De acuerdo a la causa de la enfermedad se han establecido las siguientes modalidades terapéuticas que deben ofrecerse a los pacientes afectados.
A pesar de todos los esfuerzos para detener la progresión de la fibrosis, un número significativo de pacientes progresan hacia la cirrosis hepática. Por ello es deseable evaluar nuevas alternativas que reduzcan su aparición.21-23
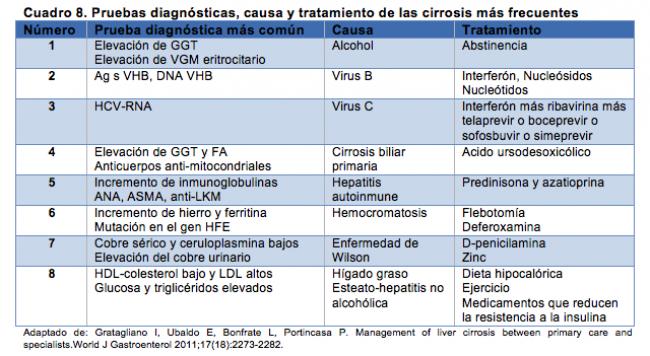
Fisiopatología de la fibrosis y búsqueda de una terapéutica.
Las células hepáticas estelares, son hasta el momento, las principales células fibrogénicas a nivel hepático, volviéndose de esta forma, unos de los blancos terapéuticos más importantes para el tratamiento.22-24, 27
El avance en la comprensión de la biología molecular del hígado, ha permitido idear estrategias terapéuticas, con el fin de evitar la fibrosis, y la consecuente pérdida de la función hepática.23
Además se han generado múltiples datos en la literatura, realizados tanto en modelos animales como en humanos con enfermedad hepática crónica que enfatizan que la fibrosis puede ser reversible, 23-26, como es el caso de aquella producida por el virus de la hepatitis C. 28.
Dentro de los nuevos fármacos para el tratamiento, la Pirfenidona (PFD) ha sido capaz de prevenir el desarrollo de lesiones fibróticas y de resolver lesiones ya existentes en el modelo de fibrosis pulmonar inducida en hámster.29
En otros estudios in vitro e in vivo, se ha reportado la utilidad de la PFD en fibrosis a nivel pulmonar, así como en otros órganos, incluida la fibrosis hepática en diferentes estadios de avance, incluida la fase final (cirrosis).24,29-33.
Pirfenidona
 En 1994 se dio a conocer un reporte preliminar donde se publican las propiedades antifibróticas de la Pirfenidona (5-metil-1-fenil-2-[1H]-piridona), una droga inicialmente conocida por sus capacidades analgésicas y antiinflamatorias.30
En 1994 se dio a conocer un reporte preliminar donde se publican las propiedades antifibróticas de la Pirfenidona (5-metil-1-fenil-2-[1H]-piridona), una droga inicialmente conocida por sus capacidades analgésicas y antiinflamatorias.30
En 1995 se describieron sus propiedades antifibróticas al administrarla en un modelo de hámster con fibrosis pulmonar inducida por bleomicina.31,32 Su mecanismo de acción, en ese tiempo no estaba completamente bien establecido. Se sabía que era a nivel transcripcional y se demostró que modulaba el depósito de matriz extracelular, la producción de citocinas, factores de crecimiento y proliferación fibroblástica.33 Se asocia con la inhibición de la producción y la actividad del TNF-α, 34 TGF-ß,interferon-gamma e IL-6 y aumenta la producción de citocinas antiinflamatorias como IL-10.35-36
La molécula PFD, ha mostrado efectos promisorios tanto in vitro como in vivo en la prevención y tratamiento de la fibrosis pulmonar, 30-33,37-38 en la prevención de la contractura capsular después de implantes mamarios,39 fibrosis intersticiales renales,40-41 en particular la glomeruloesclerosis focal y segmentaria42 o bien la nefropatía diabética43 y una gama amplia de padecimientos que comparten el fenómeno de la cicatrización anormal incluyendo las citrices hipertróficas, cicatrices queloides, esclerosis peritoneal, neurofibromatosis44 y fibromiomas uterinos.45 Más recientemente tambien se la ha evaluado en esclerosis múltiple variedad secundaria y progresiva, con resultados promisorios.46
En modelos de fribrosis hepática, también se ha demostrado que PFD posee actividad antifibrótica. El exceso de MMP-2 y los procesos de degradación aumentan la producción y proliferación de las células hepáticas estelares y, como mecanismo de retroalimentación positiva, se aumenta la expresión de colágena tipo I, promoviendo la fibrosis hepática. Por otra parte, las actividades de las diferentes metaloproteinasas (MMPs) son inhibidas por los diferentes tipos de TIMPs (TIMP-1, TIMP-2, TIMP-3 y TIMP-4), siendo TIMP-1 el más importante en el proceso de fibrosis hepática.23-24 Interesantemente, pirfenidona, a nivel celular inhibe la proliferación de las células hepáticas estelares inducida por PDGF y el TGF-ß, sin afectar su viabilidad,47 inhibe la acumulación de expresión del RNA mensajero de colágena tipo I así como la inhibición de TIMP-1.48
En modelos de cirrosis experimental en ratas se ha encontrado que PFD disminuye los niveles de aminotransferasas, bilirrubinas y estimula la regeneración celular. A nivel molecular, también se observó disminución considerable en la expresión de genes pro-fibrogénicos como colágena I, III y IV, TGF ß-1, Smad-7, TIMP-1 y el inhibidor del plasminógeno 1 (PAI-1).24,47-48
De esta manera, se sabe que la PFD posee diversas propiedades antiinflamatorias y antifibróticas, las cuales tienen sustento molecular para su aplicación como tratamiento potencial de la cirrosis hepática.49
 Desde el año 2000, la empresa mexicana Grupo Medifarma, fabrica la molécula 1-fenil-5-metil-2- (1H)-piridona (PFD), en adelante KitosCell® LP en su planta localizada en Jiutepec, Morelos. Los detalles de la formulación son confidenciales y están protegidas por derechos de patente. Sin embargo, los componentes farmacológicos del producto están balanceados y en la concentración suficiente para lograr un producto estable y con concentraciones homogéneas en los lotes de producción. La estabilidad de la fórmula de KitosCell® LP ha sido probada desde el punto de vista bioquímico, biológico y físico. Adicionalmente, las pruebas de disolución in vitro resultaron dentro de las concentraciones fisiológicas esperadas, así como las pruebas de esterilidad requeridas por la Farmacopea Mexicana. Desde el punto de vista de producción, Grupo Medifarma cuenta con experiencia para demostrar el apego a las buenas prácticas de manufactura del producto en estudio de acuerdo a los requerimientos de la Secretaria de Salud.
Desde el año 2000, la empresa mexicana Grupo Medifarma, fabrica la molécula 1-fenil-5-metil-2- (1H)-piridona (PFD), en adelante KitosCell® LP en su planta localizada en Jiutepec, Morelos. Los detalles de la formulación son confidenciales y están protegidas por derechos de patente. Sin embargo, los componentes farmacológicos del producto están balanceados y en la concentración suficiente para lograr un producto estable y con concentraciones homogéneas en los lotes de producción. La estabilidad de la fórmula de KitosCell® LP ha sido probada desde el punto de vista bioquímico, biológico y físico. Adicionalmente, las pruebas de disolución in vitro resultaron dentro de las concentraciones fisiológicas esperadas, así como las pruebas de esterilidad requeridas por la Farmacopea Mexicana. Desde el punto de vista de producción, Grupo Medifarma cuenta con experiencia para demostrar el apego a las buenas prácticas de manufactura del producto en estudio de acuerdo a los requerimientos de la Secretaria de Salud.
Es el nombre comercial registrado para la Pirfenidona, por Grupo Medifarma, en México.
Características Químicas:
- Peso Molecular: 185.2 Daltons
- Es un sólido microcristalino blanco o ligeramente amarillento, libre de cualquier contaminante visible, es inodoro y tiene un fuerte sabor amargo.
- Presenta alta solubilidad en alcohol etílico, cloroformo, varios aceites y otros solventes de grasas. A 25 ºC es soluble de 1.5 a 2% en agua destilada.
- Fórmula Condensada: C12H11NO
- Punto de fusión (104‐110º C). Se identifica por su espectro de absorción característico en infrarrojo, también por cromatografía de gases, HPLC y NMR. Análisis elemental; Carbono 77.81%, hidrógeno 5.96%, Nitrógeno 0%.
Mecanismo de acción
Estudios de biología molecular, han establecido que el mecanismo de acción de la PFD se lleva a cabo a nivel transcripcional, en el lugar donde se produce una interface entre las señales de genes específicos o grupo de genes, que están siendo transmitidas al proceso por factores transcripcionales como NFkb (factor transcripcional que regula expresión de genes proinflamatorios) y AP-1 (factor transcripcional que regula expresión de proteínas colagénicas).33-41
 La transmisión de las señales por las proteínas NFkb y AP-1, en su momento regulan eventos mitóticos (Go a Gs) y ejercen control vía CDK, señalizando a los genes que influyen en el proceso de transcripción y son determinantes para implementar numerosos procesos bioquímicos, de una variedad de compuestos biológicos, que son liberados para complementar o regular a otras células en el medio adyacente, la inducción de la proliferación celular así como la formación de colágena intersticial o matriz amiloidea. 34
La transmisión de las señales por las proteínas NFkb y AP-1, en su momento regulan eventos mitóticos (Go a Gs) y ejercen control vía CDK, señalizando a los genes que influyen en el proceso de transcripción y son determinantes para implementar numerosos procesos bioquímicos, de una variedad de compuestos biológicos, que son liberados para complementar o regular a otras células en el medio adyacente, la inducción de la proliferación celular así como la formación de colágena intersticial o matriz amiloidea. 34
Datos obtenidos de estudios realizados en modelos animales in vivo, en fibroblastos de humano y otras células mesenquimatosas in vitro, plantean que la PFD puede considerarse como agente terapéutico para la prevención y/o tratamiento de enfermedades que cursan con un factor común “la fibrosis”; entre ellas se incluyen: fibrosis hepática avanzada, adherencias post-quirúrgicas, fibrosis renal, fibrosis pulmonar y cicatrices hipertróficas. La PFD modula o inhibe de manera selectiva, la actividad de citocinas proinflamatorias y profibróticas, las cuales son directamente responsables de la exacerbación del proceso inflamatorio crónico y fibrótico, así como la excesiva proliferación de fibroblastos o células relacionadas con la fibrosis.33-41
Por todo ello, se considera la PFD como recurso terapéutico para:
- Prevenir la formación de lesiones fibróticas.
- Disminuir el avance fibrótico preexistente.
- Revertir lesiones fibróticas.
En virtud de que es una molécula no proteica, no hay evidencia de formación de anticuerpos en su contra, lo cual minimiza la posibilidad de crear alguna reacción inmunogénica.49
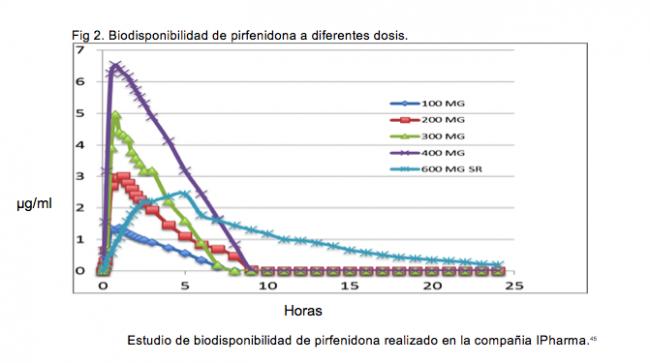
Por otro lado, estudios de Biodisponibilidad y Farmacocinética50 efectuados en sujetos sanos que recibieron una dosis única de 600 mg en tabletas de liberación prolongada, por vía oral de Pirfenidona muestran lo siguiente:
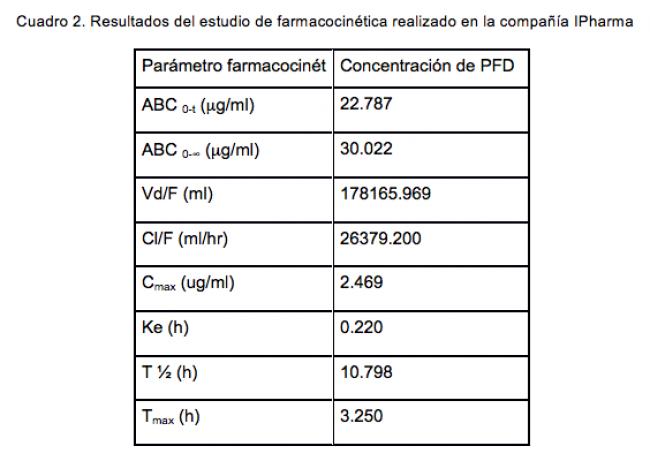
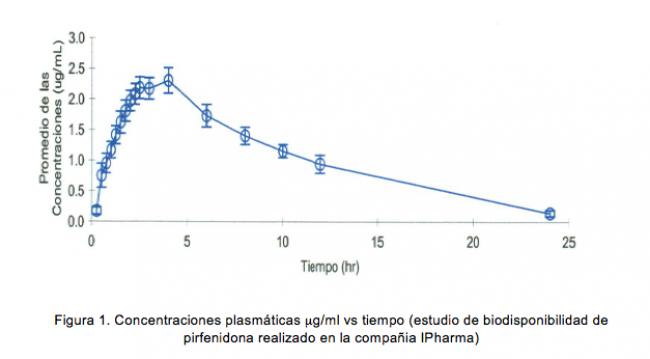
En base a estos resultados, se demuestra que el ABC (0-t) de la forma farmacéutica de 600 mg, en tabletas de liberación prolongada, es de 22.787 mg/ml, siendo la concentración máxima 2.4 mg/ml, la cual se alcanza en una Tmax de 3.25 h y una vida media (T1/2) de 10.79 h. De acuerdo a estos resultados podemos establecer que la actividad farmacológica de la forma farmacéutica (tabletas liberación prolongada 600 mg) se mantiene en concentraciones de 1 a 2.5 mg/mL hasta por casi 8 horas.50
En otros estudios farmacocinéticos se demostró que la PFD se une a proteínas plasmáticas, principalmente: albúmina sérica. El porcentaje de unión varía entre el 50% y el 58% en las concentraciones observadas en estudios clínicos (entre 1 y 100 μg/ml).51.52
El volumen de distribución medio aparente por vía oral es de aproximadamente 70 litros, lo que indica que la distribución de la PFD en los tejidos es modesta. 51.52
Estudios metabólicos in vitro con microsomas hepáticos indican que aproximadamente el 48% de la PFD es metabolizada principalmente por CYP1A2 y menos del 13% es realizado por otras isoenzimas CYP, como CYP2C9, 2C19, 2D6 y 2E1. En los estudios in vitro e in vivo realizados, hasta la fecha no se ha detectado ninguna interacción del metabolito principal (5-carboxi-pirfenidona), ni con concentraciones muy por encima de las asociadas a la actividad de la propia Pirfenidona. 51.52
La depuración de la PFD por vía oral parece ser parcialmente saturable. Tras la administración de una dosis única de PFD en adultos sanos, la semivida de eliminación fue de aproximadamente 2.4 horas. (Ke 0.220). 51.52
Aproximadamente el 80% de la dosis de Pirfenidona administrada por vía oral se elimina en la orina en las 24 horas siguientes a su administración. La mayor parte se excreta en forma del metabolito 5-carboxi-pirfenidona (más del 95) y menos del 1 % se recupera intacta en la orina. 51.52
Eficacia clínica de la Pirfenidona (PFD).
Para evaluar la acción de PFD se han efectuado diversos estudios, tanto en humanos como en modelos experimentales,24,39,42-46 donde se ha mostrado que PFD inhibe la proliferación de células proinflamatorias, los estudios han sido pequeños, con resultados variables, encontrando en general un efecto benéfico y la necesidad de estudios clínicos controlados aleatorizados más grandes.
La mayoría de los estudios más completos y largos sobre el uso de PFD ha sido en fibrosis pulmonar idiopática, 53-54 en donde la PFD ha demostrado estabilizar la función pulmonar, en un padecimiento progresivo y de elevada mortalidad, por lo cual se ha logrado la autorización para comercialización por parte de la agencia europea de medicamentos, así como las agencias regulatorias de Japón, Canadá y más recientemente México.
 También se han realizado otros estudios donde se demostró que PFD inhibe la síntesis y/o liberación de colágena u otros péptidos en cultivos de células animales y humanas:
También se han realizado otros estudios donde se demostró que PFD inhibe la síntesis y/o liberación de colágena u otros péptidos en cultivos de células animales y humanas:
Se demostró que se puede prevenir farmacológicamente la biosíntesis y liberación excesiva de colágena en cultivos celulares de fibroblastos de pulmón humano tipo W138 y IMR90 al utilizar Pirfenidona en el medio de cultivo a dosis-respuesta, este efecto se observó con dosis 10 a 50 veces menores que las concentraciones citotóxicas en medios de cultivo idénticos. 29
Se probó que PFD oral logra la inhibición de la biosíntesis y liberación de hidroxiprolina de células in vivo en inducción de fibrosis pulmonar experimental con Bleomicina en hámsters. 30-32
Logró inhibir farmacológicamente la liberación excesiva de TGF-β1 después de lipopolisacaridos (LPS) de macrófagos humanos (Monocitos THP-1), en concentraciones dosis-respuesta 10 a 30 veces menores que las concentraciones que muestran citotoxicidad en medios de cultivo celulares idénticos. 33
Logró inhibir farmacológicamente la liberación excesiva de factor de crecimiento derivado de las plaquetas AB (PDGF-AB) inducido por LPS de macrófagos humanos (Monocitos de la línea celular THP1), en concentraciones dosis-respuesta 10 a 100 veces menores que las concentraciones que muestran citotoxicidad en medios de cultivo celulares idénticos. 34
La biosíntesis y liberación excesiva de glucosaminoglicanos por fibroblastos dérmicos fue inhibida por Pirfenidona a dosis-respuesta con concentraciones que fueron 10 a 50 veces menores que las concentraciones citotóxicas para estas células. 38
Como estudios preclínicos se realizaron estudios en modelos experimentales de cirrosis en ratas. Se realizaron 3 grupos de ratas: 1 grupo control y 2 grupos con diferentes dosis de PFD (200 mg y 500 mg) al día, por 11 semanas. Posteriormente fueron sacrificadas y el análisis histopatológico del hígado mostró disminución significativa de la fibrosis hepática en los grupos que recibieron PFD.24
El primer estudio clínico piloto para evaluar el efecto de pirfenidona en pacientes con fibrosis hepática viral C, fue realizado por J. Armendáriz-Borunda y cols., en el Hospital Civil de Guadalajara en conjunto con el Instituto de Biología Molecular en Medicina y Terapia Génica.55
En este estudio piloto, abierto, se incluyeron tan solo 15 pacientes con fibrosis hepática de diversas etiologías y diverso estadio funcional hepático. Las biopsias hepáticas realizadas después de 12 meses, sugirieron que en el 53.3% de los pacientes hubo una reducción de dos puntos o más en el índice necro-inflamatorio (HAI), 60% de la esteatosis disminuyó y 30% mejoró de la fibrosis, mientras que se detectó un 70% de actividad de regeneración.55
Seguridad.
Archivos de ensayos clínicos y de laboratorios de farmacología en animales, así como datos de seguridad toxicológica, indican que la PFD es bien tolerada por los pacientes y que no produce reacciones adversas graves. Las reacciones adversas descritas incluyen manifestaciones gastrointestinales, fatiga y fotosensibilidad.51-52.
En un meta-análisis reciente publicado en China se realizó una búsqueda sistemática de Pub Med, Embase y registros de estudios controlados publicados por Cochrane entre enero de 1999 y octubre 2011 se observó que la PFD no era bien tolerada por los pacientes que recibían dosis mayores a 1800 mg por los efectos adversos gastrointestinales, neurológicos y dermatológicos registrados.56
 Más de mil personas han participado en estudios Fase I a III de investigación clínica, bajo las reglas y protocolos establecidos por la FDA para un nuevo fármaco. Adicionalmente más de 200 sujetos, han recibido la PFD por más de un año, de manera continua.56
Más de mil personas han participado en estudios Fase I a III de investigación clínica, bajo las reglas y protocolos establecidos por la FDA para un nuevo fármaco. Adicionalmente más de 200 sujetos, han recibido la PFD por más de un año, de manera continua.56
La mayoría de los estudios clínicos describen que PFD es bien tolerada a dosis crecientes hasta 2400 mg al día (dividido en 800mg cada 8 h). Sin embargo, los efectos adversos gastrointestinales (nausea, dispepsia, diarrea, anorexia, fatiga) pueden presentarse hasta en el 44% de los pacientes.56
Los efectos adversos son de aparición temprana y son dosis dependiente (probablemente relacionados con picos de concentración sanguínea elevada) y se resuelven con la suspensión del medicamento. La mayoría de los efectos adversos gastrointestinales pueden mejorar con la ingesta del medicamento junto con alimentos. Estudios realizados recientemente por Grupo Medifarma, en voluntarios sanos, con el fin de mejorar la biodisponibilidad, han permitido comparar la farmacocinética de la PFD de absorción rápida con la PFD de liberación prolongada (KitosCell® LP). Los hallazgos en ese estudio demuestran que la Cmax es menor en los sujetos que recibieron KitosCell® LP. Es importante hacer notar que los niveles del ABC se mantienen constantes por 12 horas, a diferencia de la PFD de absorción rápida que solamente permanece por 3 horas.57
Referencias.
- Gratagliano I, Ubaldo E, Bonfrate L, Portincasa P. Management of liver cirrosis between primary care and specialists.World J Gastroenterol 2011;17(18):2273-2282.
- Martin P, DiMartiniA, Feng S, Brown R, Fallon M. Evaluation for Liver Transplantation in Adults: 2013Practice Guideline by the American Association for theStudy of Liver Diseases and the American Society ofTransplantation. Hepatology 2014;59(3):1144-1165.
- Bernal V, Bosh J. Cirrosis Hepática. Hígado. Asociación Española de Gastroenterología. 2010; 60: 867–892.
- Yen‐Chieh Lee, Chia‐Hsuin Chang, Jou‐Wei Lin, Hsi‐Chieh Chen, Min‐Shung Lin, Mei‐Shu Lai. Non-steroidal anti-inflammatory drugs use and risk of upper gastrointestinal adverse events in cirrhotic patients. Liver International 2012, 32(5): 859-866.
- Friedman SL, Rockey DC, Bissell DM. Hepatic fibrosis 2006: report of the Third AASLD Single Topic Conference. Hepatology 2007; 45: 242–249.
- Fallowfield J A. Therapeutic targets in liver fibrosis. Am J Physiol Gastrointest Liver Physiol 2011; 300:G709-G715.
- Rockey D. Translating an understanding of the pathogenesis of hepatic fibrosis to novel therapies. Clinical Gastroenterology and Hepatology 2013;11,3:224-231.
- García L, Hernández I, Sandoval A, Salazar A, Garcia J, Vera J, Grijalva G, Muriel P, Margolin S, Armendariz-Borunda J.Pirfenidone effectively reverses experimental liver fibrosis. J Hepatol2002;37 (6): 797-805.
- Schuppan D, Afdhal N. Liver cirrhosis. Lancet 2008; 371: 838-51.
- Takahara T, Furui K, Funaki J, Nakayama Y, Itoh H, Miyabayashi C, Sato H, Seiki M, Ooshima A, Watanabe A. Increased expression of matrix metalloproteinase- II in experimental liver fibrosis in rats. Hepatology 1995; 21:787–95.
- Fallowfield J A. Therapeutic targets in liver fibrosis. Am J PhysiolGastrointest Liver Physiol 2011; 300:G709-G715.
- Poynard T, Bedossa P, Opolon P. Natural history of liver progression in patients with chronic hepatitis C. Lancet 1997; 349: 825-32.
- Hisatomi K, Mukae H, Sakamoto N, Ishimatsu Y, Kakugawa T, Hara S, Fujita H, Nakamichi S, Oku H, Urata Y, Kubota H, Nagata K, Kohno S.Pirfenidone inhibits TGF-β1-induced overexpression of collagen type I and heat shock protein 47 in A549 cell. BMC Pulmonary Medicine 2012; 12:24
- Margolin S. Lefkowitz S. Pirfenidone: a novel pharmacological agent for prevention and resolution of lung fibrosis. FASEB Journal 1994; 8(4): A382.
- Lurton JM, Trejo T y Narayanan AS. Pirfenidone inhibits the stimulatory effects of profibrotic cytokines on human lung fibroblast in vitro. Am Jour Resp and Critical care Med 1996; 153: A403.
- Schelegle ES, Mansoor JK, Giri S.Pirfenidone attenuates bleomycin-induced changes in pulmonary functions in hamsters. ProcSocExpBiol Med.1997; 216(3):392-397.
- Iyer SN, Hyde DM, Giri SN.Anti-inflammatory effect of pirfenidone in the bleomycin-hamster model of lung inflammation. Inflammation 2000; 24:477–91.
- Schaefer CJ, Ruhrmund DW, Pan L, Seiwert SD, Kossen K. Antifibrotic activities of pirfenidone in animal models. Eur Respir Rev 2011; 20: 120, 85–97.
- Nakazato H, Oku H, Shoji Yamane, Yuji Tsuruta, Ryuji Suzuki. A novel anti-fibrotic agent pirfenidone suppresses tumor necrosis factor-alpha at the translational level. Eur J Pharmacol2002; 446: 177-85.
- Zheng WD, Zhang LJ, Shi MN, Chen Z, Yun-Xin Chen, Yue-Hong Huang, Xiao-Zhong Wang. Expression of matrix metalloproteinase 2 and tissue inhibitor of metalloproteinase-1 in hepatic stellate cells during rat hepatic fibrosis and its intervention by IL-10.World J Gastroenterol2005; 11 (12): 1753-1758.
- Spond J, Case N, Chapman RW, Crawley Y, Egan RW, Fine J, Hey JA, Kreutner W, Kung T, Wang P, Minnicozzi M. Inhibition of experimental acute pulmonary inflammation by pirfenidone. Pulm Pharmacol Ther 2003;16(4):207-14.
- Hirano A, Kanehiro A, Ono K, Ito W, Yoshida A, Okada C, Nakashima H, Tanimoto Y, Kataoka M, Gelfand EW, Tanimoto M. Pirfenidone Modulates Airway Responsiveness, Inflammation, and Remodelingafter Repeated Challenge. Am J Respir Cell MolBiol 2006; 35: 366-377.
- Gancedo M, Ruiz-Corro L, Salazar-Montes A, Rincón AR, Armendáriz-Borunda J. Pirfenidone Prevents Capsular Contracture after Mammary Implantation. AesthPlastSurg 2008;32 (1): 32-40.
- Shimizu T, Kuroda T, Hata S, Fukagawa M, Margolin SB, Kurokawa K. Pirfenidone improves renal function and fibrosis in the post-obstructed kidney. Kidney Int 1998; 54: 99-109.
- Hewitson TD, Kelynack KJ, Tait MG, Martic M, Jones CL, Margolin SB, Becker GJ.Pirfenidone reduces in vitro rat renal fibroblast activation and mitogenesis. J Nephrol 2001; 14:453–460.
- Cho ME, Smith DC, Branton MH, Penzak SR, Kopp JB.Pirfenidone slows renal function decline in patients with focal segmental glomerulosclerosis. Clin J Am SocNephrol 2007 Sep;2(5):906- 913.
- Sharma K, Ix JH, Mathew AV, Cho M, Pflueger A, Dunn SR, Francos B, Sharma S, Falkner B, McGowan TA, Donohue M, Ramachandrarao S, Xu R, Fervenza FC, Kopp JB. Pirfenidone for diabetic nephropathy. J Am SocNephrol 2011 Jun; 22(6):1144-51.
- Babovic-Vuksanovic D, Widemann BC, Dombi E, Gillespie A, Wolters PL, Toledo-Tamula MA, O'Neill BP, Fox E, MacDonald T, Beck H, Packer RJ.Phase I Trial of Pirfenidone in Children with Neurofibromatosis 1 and PlexiformNeurofibromas. PediatrNeurol 2007; 36 (5): 293-300.
- Lee B. Lee BS, Margolin SB, Nowak RA. A novel pharmacological agent that inhibits leiomyoma cell proliferation and collagen production.JCEM 1998, 83(1):219-223
- Walker JE, Giri SN, Margolin SB. A double-blind, randomized, controlled study of oral pirfenidone for treatment of secondary progressive multiple sclerosis. MultScler 2005; 11:149–158.
- Di Sario A, Bendia E, Baroni GS, Ridolfi F, Casini A, Ceni E, SaccomannoS, Marzioni M, Trozzi L, Sterpetti P, Taffetani S, Benedetti A. Effect of Pirfenidone on rat hepatic stellate cell proliferation and collagen production. J Hepatol2002; 37: 584-91.
- Di Sario A, Bendia E, Macarri G, Candelaresi C, Taffetani S, Marzioni M,Omenetti A, De Minicis S, Trozzi L, Benedetti A.The anti-fibrotic effect of pirfenidone in rat liver fibrosis is mediated by downregulation of procollagenalphal(I), TIMP-1 and MMP-2. Dig Liver Dis 2004; 36: 744-51.
- Macías-Barragán J, Sandoval-Rodriguez A, Navarro Partida J, Armendáriz-Borunda J. The multifaceted role of pirfenidone and its novel targets.Fibrogenesis& Tissue Repair 2010;3:16.
Material Didáctico:
Dra. Fernanda García Alvarado.
Comité Editorial Amhigos del Hígado


