TRASTORNOS DE LA COAGULACIÓN EN PACIENTES CON ENFERMEDAD HEPÁTICA
- Escrito por Dra. Juanita Pérez Escobar
- Publicado en Prevención

Como resultado de estos conceptos y prácticas, los pacientes con enfermedad hepática se establecieron entre los mejores clientes de bancos de sangre, particularmente para el plasma administrado profilácticamente. En la misma línea histórica, la anticoagulación debía evitarse siempre que fuera posible en estos pacientes porque ya estaban "Auto-anticoagulados". Ahora las cosas parecen extraordinariamente complicadas y no tan sencillas como solían ser, puesto que se entiende mejor el frágil equilibrio de los factores procoagulantes y anticoagulantes en el paciente cirrótico.
¿QUÉ ESTÁ MAL CON LA PRUEBA INR EN EL PACIENTE CON ENFERMEDAD HEPÁTICA?
Como medida de hemostasia en la cirrosis, el INR tiene tantas deficiencias, siendo inexacto para evaluar el estado de coagulación del paciente. El "INR" se normalizó a varias tromboplastinas en la evaluación de la terapia con warfarina, donde probablemente sea una prueba válida. Sin embargo, esos criterios cambian cuando se aplican a pacientes con enfermedad hepática, a menos que se realice la normalización a la enfermedad hepática. Esto se ha establecido sólidamente y da como resultado una variación significativa entre laboratorios en el INR dependiendo de qué reactivos fueron comprados por el laboratorio clínico. Además, se ha demostrado in vitro y recientemente in vivo que la adición de plasma terapéutico (10 mL / kg, mucho más alto que "2 unidades FFP") no mejora la generación de trombina y, de hecho, puede disminuir la generación de trombina probablemente al reponer la proteína anticoagulante C. En la Cirrosis es difícil establecer un punto de corte normal del INR, así como un INR profiláctico en pacientes con Warfarina o en los antagonistas de la vitamina K.
¿CÓMO SE DEBE ABORDAR EL RIESGO POR SANGRADO DEL PACIENTE CON ENFERMEDAD HEPÁTICA?
Aunque hay una escasez de estudios prospectivos, ha surgido una guía de consenso con respecto a estrategias alternativas para el manejo del riesgo de hemorragia en pacientes con cirrosis a la luz de las deficiencias bien fundadas de las estrategias anteriores, esto se reduce a recomendaciones pragmáticas para apuntar a recuentos de plaquetas de alrededor de 50.000 y niveles de fibrinógeno de 120 a 150 mg / dL. Estas recomendaciones están respaldadas por estudios de hemorragia en pacientes críticamente enfermos con cirrosis. Sin embargo, cada vez más, las pruebas viscoelásticas de sangre total (tromboelastografía (TEG), tromboelastometría rotacional [ROTEM] y sonorreometría) se están utilizando con éxito para apoyar enfoques más restrictivos de la profilaxis sin detrimento evidente. Otras consideraciones clave que pueden afectar la hemostasia incluyen la infección y la insuficiencia renal. El conocimiento de los cambios en la fisiología del fibrinógeno en la cirrosis (disfibrinógeno) está emergiendo en cuanto a si estos cambios mejoran o disminuyen la estabilidad del coágulo. Por último, la homeostasis alterada en el sistema fibrinolítico puede conducir a un estado de hemorragia difusa de la mucosa y de la herida por punción, y hemorragia tardía posterior al procedimiento debido a la disolución prematura del coágulo. Esta afección se puede tratar eficazmente con agentes antifibrinolíticos como el ácido aminocaproico y el ácido tranexámico.
¿QUÉ PASA CON LA HIPERCOAGULACIÓN EN LA ENFERMEDAD HEPÁTICA?
La Trombosis de la Vena Porta (TVP) es la manifestación más representativa del estado de hipercoagulabilidad en pacientes con enfermedad hepática. Este problema es distinto de la TVP no cirrótica y se relaciona claramente con los elementos clave de la tríada de Virchow en la cirrosis: hipercoagulabilidad, especialmente por la disminución de la proteína C y el aumento de los factores de coagulación VIII y vWF; lesión endotelial por enfermedad hepática subyacente; y flujo lento (estasis) por aumento de la resistencia hepática y / o derivaciones portosistémicas, especialmente derivaciones esplenorrenales espontáneas, que provocan un flujo estancado a través de un efecto sumidero en la vena porta.
Los factores genéticos como el factor V de Leiden o la mutación de la protrombina pueden jugar un pequeño papel en este riesgo y en las decisiones sobre el tratamiento, pero este último realmente depende más de los síntomas, la extensión de la trombosis y especialmente del estado del trasplante. En general, la terapia anticoagulante se ha asociado retrospectivamente con mayores tasas de repermeabilidad de la vena porta sin mayor riesgo de hemorragia por varices, presumiblemente debido al efecto de reducción de la presión portal de una vena porta permeable.
Sin embargo, el riesgo / beneficio de la terapia requiere una consideración cuidadosa de los síntomas potencialmente asociados y la extensión del trombo, así como el riesgo de hemorragia y caídas. Además, deben tenerse en cuenta otras dos condiciones algo opuestas. Primero, la TVP, especialmente cuando es parcial o no oclusiva, a menudo se abre espontáneamente a través del sistema fibrinolítico de remodelación del coágulo. En segundo lugar, entre los pacientes que esperan un trasplante, la cirugía con una TVP agrega una capa significativa de complejidad y puede afectar negativamente los resultados del trasplante.
¿DONDE NOS ENCONTRAMOS AHORA?
Ahora se ha establecido que el INR no es una medida adecuada del riesgo de hemorragia, y la prolongación de esta prueba de laboratorio en la cirrosis no representa una "autoanticoagulación". Es una medida razonable del tratamiento con antagonistas de la vitamina K, pero en la cirrosis, el INR prolongado puede asociarse con hipercoagulabilidad. Cada vez más, las medidas de fibrinógeno, el recuento de plaquetas y, más recientemente, las pruebas viscoelásticas de sangre total (TEG, ROTEM y sonorreometría) se utilizan como mejores indicadores del sistema hemostático en la cirrosis. La expansión de volumen es contraproducente en la hemorragia relacionada con la hipertensión portal y debe minimizarse para evitar la ingurgitación del sistema venoso mesentérico. Por el contrario, el sangrado difuso de la mucosa o de la herida punzante debe reconocerse como una disolución prematura del coágulo (hiperfibrinólisis) debido a cambios en el sistema activador plasminógeno-plasmina y se trata mejor con agentes antifibrinolíticos. La activación intrahepática de la cascada hemostática puede ser la base del desarrollo de la atrofia de órganos en etapa terminal causada por microtrombos en un proceso llamado extinción del parénquima. Se necesitan más estudios para evaluar el posible beneficio de la anticoagulación crónica en la cirrosis estable para prevenir la progresión de la enfermedad clínica. Con respecto a la TVP, la manifestación más evidente y común del estado de hipercoagulabilidad en la cirrosis, las decisiones con respecto al tratamiento deben sopesarse cuidadosamente a la luz de la carga de trombos, los síntomas, el riesgo de hemorragia, el riesgo de caídas, el estado del trasplante y con el conocimiento de que la carga de coágulos menor a menudo se resuelve sin intervención específica.
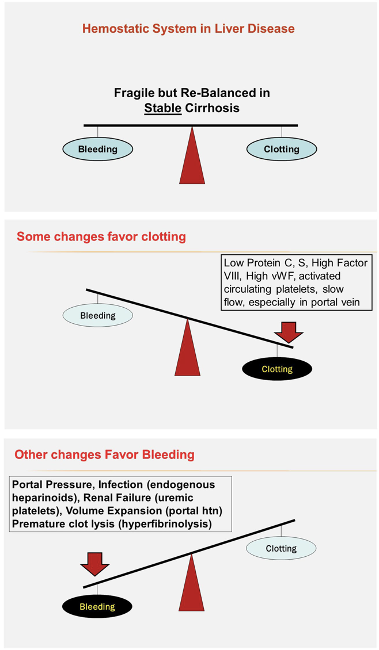
El Dr. Jorge Luis Poo, Hepatólogo Clínico, comenta que este artículo de revisión permite reflexionar sobre el fino equilibrio que debe existir entre la primera etapa de nuestra respuesta de coagulación (dependiente de plaquetas), la segunda etapa (dependiente de proteínas como la trombina) y la tercera fase, que lleva a la resolución del coágulo (fibrinolisis) dependiente de fibrina. En la clínica, podemos medir los tres, plaquetas, trombina y fibrina, pero de acuerdo a este artículo, una nueva generación de pruebas de coagulación está por llegar.
REFERENCIA
1. Caldwell S, Carlini LE. Coagulation Homeostasis in Liver Disease. Clinical Liver Disease, Vol 16, No 4, October 2020.


