EFECTOS DE EMRICASAN, DE NOVARTIS, EN FIBROSIS HEPÁTICA F1-F3
- Escrito por Dr.Poo
- Publicado en Fibrosis Hepática

.
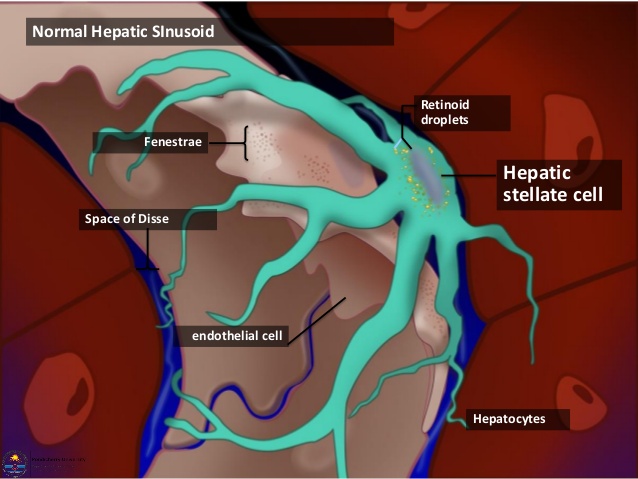
Sobre las células estelares, antiguamente llamadas células de Ito o bien células estrelladas, se sabe que son capaces de modificar su forma física y sus funciones fisiológicas convencionales para transformarse en las princales células productoras de colágena. La colágena se distribuye en forma de fibras, a manera de una telaraña, que en condiciones normales permite dar sustento o apoyo para el crecimiento de las células hepáticas, pero que en exceso se convierte en un obstaculo para la comunicación intercelular, un fenómeno conocido como cicatrización excesiva o fibrosis.
Por otro lado, sabemos que en condiciones de enfermedad crónica y activa por alcohol, virus, autoinmunidad o hígado graso metabólico, las células estelares reciben estímulos para su reproducción y transformación con el supuesto de que hay que reparar el tejido dañado. Sin embargo, llega un momento en que aunque ya no haya daño activo por los agentes mencionados, las células estelares siguen activadas y en una perpetua producción de colágena, generando el grave problema llamado FIBROSIS. Desde luego que existe un proceso de reversión de la fibrosis a través de otras proteínas llamadas colagenasas o metaloproteasas de matriz, que degradan a la colágena existente en las zonas de fibrosis. Sin embargo, paradojicamente, se han detectado inbidores tisulares de estas metaloproteasas que aunque se produzcan son inhibidas. De esa manera, el tejido fibroso continua y se perpetua.
En el caso de la Enfermedad por Hígado graso metabólico (es decir, asociado a Obesidad, Diabetes o Hiperlipidemia), se ha descriton cambios de degeneración balonoide de las células (esteatosis simple), ruptura celular que induce una respuesta inflamatoria (esteato-hepatitis) y posteriormente fibrosis hepática que suele ser progresiva si no se detiene el estímulo activador (esteato-hepatitis más fibrosis)..
Por ello. se han buscado diversas opciones terapéticas que inhiban este proceso de muerte celular. De hecho, cada día, el cuerpo humano produce y elimina de forma silenciosa millones de células, gracias a un perfecto equilibrio entre proliferación y muerte celular, con el fin de garantizar la homeostasis celular, así como un correcto funcionamiento en todo momento del cuerpo humano. Las celulas pueden morir de forma accidental o regulada. Un ejemplo de la primera sería un traumatismo, una mordedura o una quemadura lo cual no puede ser regulada o controlada. Por el contrario, las formas de muerte reguladas están codificadas genéticamente y ocurren para ofrecer una respuesta adaptativa a estímulos externos o intracelulares. Por tanto, pueden ser moduladas inhibiendo la transducción de las señales de muerte.
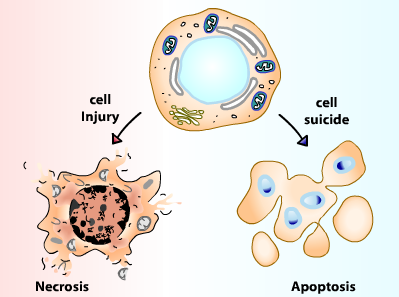
Dos de las formas más destacadas de muerte celular son la necrosis y la apoptosis (ver figura anexa ). La primera se ha asociado a muerte accidental, por ejemplo la llegada de un infección por amibas (un parásito) en el hígado. Sin embargo, se ha visto que también puede estar regulada, por lo que recientemente se ha denominado también necroptosis, para enfatizar su naturaleza modulada o programada. Es posible que en la EHGM la muerte celular sea en parte debida a necroptosis que termina provocando la rotura de la membrana celular, por lo que el contenido celular se vierte al medio extracelular, afectando así a las células adyacentes. Se trata por tanto de un tipo de "muerte proinflamatoria".
Por otro lado, la apoptosis constituye la principal forma de muerte celular en condiciones fisiológicas. Es un proceso dependiente de las enzimas llamadas caspasas, que puede iniciarse ya sea en respuesta a estímulos externos o bien a estímulos internos de la propia célula, como exceso de proteínas mal plegadas o una catástrofe energética. En este mecanismo, la integridad de la membrana celular se mantiene en todo momento, y termina con la formación de fragmentos celulares denominados cuerpos apoptóticos, que son posteriormente fagocitados (o comidos) por macrófagos y otras células del sistema inmunitario. Se trata por tanto de un proceso no inflamatorio y altamente controlado, que no afecta a las células vecinas.
Dentro de los factores reguladores de la muerte celular existen las caspasas, un grupo de enzimas intracelulares que se clasifican en caspasas iniciadoras, como las caspasas 2, 8, 9 y 10, o en caspasas efectoras, como las caspasas 3, 6 y 7. Dado que la muerte puede deberse a un estímulo extracelular o intracelular, se sabe que, la activación de la caspasa 8 se considera un mecanismo de iniciación de la vía extrínseca de la apoptosis, es decir, en respuesta a estímulos externos, mientras que la caspasa 9 está involucrada en la iniciación de la vía intrínseca, donde la mitocondria desempeña un papel importante.
A principios del año 2010 se descubrieron diversos inibidores de caspasas y el más avanzado y prometedor de ellos se denomina EMRICASAN, un potente inhibidor pan-caspasa que demostró su eficacia en un modelo de hipertensión portal y fibrosis hepática experimental. Por ello, un grupo de investigadores clínicos, con el financiamiento de la empresa NOVARTIS iniciaron un par de estudios clínicos, de fase 3, que se resumen a continuación.
El primero de ellos fue liderado por el Dr. Stephen Harrison, investigador del Pinnacle Clinical Research Center, en San Antonio Texas y el segundo fue liderado por la conocida Dra. Guadalupe García-Tsao, de origen mexicano e Investigadora de la Universidad de Yale en New Haven, Connecticut. Participaron un amplio número de centros en los Estados Unidos y Europa y fueron publicados en el mes de mayo de 2020, en la prestigiosa revista llamada Journal of Hepatology..
Objetivo del estudio 1: Evaluar si la administración por 72 semanas de EMRICASAN versus PLACEBO podría mejorar la fibrosis hepática, sin empeoramiento de la esteato-hepatitis.
Objetivo del estudio 2: Evaluar si la administración por 72 semanas de EMRICASAN, versus PLACEBO podrían mejorar la hipertensión portal.
Metodología:
En el primer estudio se incluyeron 318 pacientes para recibir emricasan, dos veces al día, por 72 semanas, a las dosis de 5 mg, 50 mg, o placebo, en diseño doble-ciego, es decir, ni los pacientes, ni los investigadores sabían que fármaco y que dosis recibían.Todos los pacientes tenían Esteato-Hepatitis y fibrosis hepática grados 1, 2 o 3, de acuerdo a una biopsia hepática y lectura por un patólogo independiente y sin conocimiento del esquema terapéutico.
En el segundo estudio se incluyeron a 263 pacientes quienes recibieron dos dosis al día de EMRICASAN, por 48 semanas, a las dosis de 5 mg, 25 mg, 50 mg o placebo, también en diseño doble ciego. En todos se realizó la medición del gradiente de presión de venas suprahepáticas en forma basal y a las 48 semanas.
Resultados: En cuanto al primer estudio, se detectó una mejoría en la fibrosis hepática, de acuerdo a la evaluación histológica, de la siguiente magnitud:
- Emricasan 5 mg: 11.2%
- Emricasan de 50 mg: 12.3%
- Placebo: 19%
Sobre la resolución de la Esteato-Hepatitis, los hallazgos fueron de
- Emricasan 5 mg: 3.7%
- Emricasan de 50 mg: 6.6%
- Placebo: 10.5%
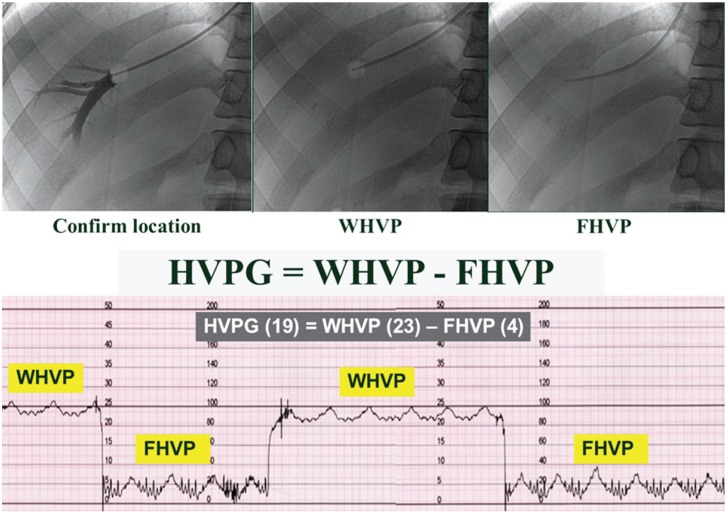 Sobre el segundo estudio, con 263 pacientes, Al compararse con placebo, los cambios en el gradiente de presión de venas supra-hepáticas fueron de la siguiente magnitud:
Sobre el segundo estudio, con 263 pacientes, Al compararse con placebo, los cambios en el gradiente de presión de venas supra-hepáticas fueron de la siguiente magnitud:
- Emricasan de 5 mg versus placebo: -0.21 mmHg
- Emricasan de 25 mg versus placebo: -0.45 mmHg
- Emricasan de 50 mg versus placebo: -0.58 mmHg
Las diferencias encontradas no fueron significativas, ni clinicamente, ni desde el punto de vista estadístico.
Conclusión: EMRICASAN no resultó eficaz para reducir la fibrosis hepática, la actividad de la esteatohepatitis ni el gradiente de presión de venas suprahepáticas.
El Dr. Jorge Luis Poo, Hepatólogo Clínico, comenta que estos dos estudios han causado una gran decepción en un numeroso grupo de investigadores a nivel internacional interesados en el mecanismo de acción de la inhibición de la muerte celular y en particular de la apoptosis. Lo llamativo es que tenía una fuerte lógica biológica basada en resultados de estudios experimentales que apoyaron su paso a la esfera clínica. Posteriormente, diversos estudios clínicos, abiertos, también indicaban un posible efecto benéfico sobre el gradiente de presión de venas suprahepáticas. Uno de ellos evaluó el efecto de la toma de emricasan por 28 días, en un número pequeño de sujetos (23 pacientes) y demostró que si se reducía el gradiente de presión en venas supra-hepáticas, por lo menos a corto plazo. Lamentablemente EMRICASAN, en diseño doble ciego y administración prolongada por 48-74 semanas falla en demostrar su eficacia como medicamento antifibrótico y/o protector contra la esteato-hepatitis.
El Dr. Juan Armendariz Borunda, Director del Instituto de Biología Molecular en Medicina del CUCS de la Universidad de Guadalajara y Profesor Distinguido del Tecnológico de Monterrey, Campus Guadalajara, comentó acerca de estos dos estudios que a pesar de tener un sustento preclínico bastante robusto, las observaciones realizadas ya en el escenario clínico en el contexto de ensayos más controlados (doble-ciego) no fueron satisfactorias en la disminución de la fibrosis hepática temprana. Es importante hacer notar para los lectores que en nuestro país se están conduciendo ensayos similares con un medicamento denominado Pirfenidona de liberación prolongada (LP), el cual ha demostrado seguridad y eficacia tanto a nivel experimental (datos obtenidos con animales de laboratorio a los cuales se les indujo el daño hepático) como en pacientes. Sin embargo, los resultados recientes han mostrado que el medicamento en cuestión (pirfenidona LP) es capaz de revertir la fibrosis en pacientes cuyo daño hepático era más avanzado que en los pacientes referidos y tratados con EMRICASAN. Estos hallazgos originales sugieren que independientemente de los esfuerzos realizados en otras partes del mundo por encontrar terapias antifibróticas, también se llevan a cabo trabajos de punta en México en este respecto (ver estudio: https://www.amhigo.com/actualidades/ultimas-noticias/53-fibrosis-hepatica/1047-la-pirfenidona-mejora-la-enfermedad-por-higado-graso).
Referencias:
1. Stephen A Harrison, Zachary Goodman, Abdul Jabbar, Ravi Vemulapalli, Ziad H Younes, Bradley Freilich, Muhammad Y Sheikh, Jörn M Schattenberg , Zeid Kayali, Adam Zivony, Aasim Sheikh, Javier Garcia-Samaniego, Sanjaya K Satapathy, George Therapondos, Edward Mena, Detlef Schuppan, James Robinson, Jean L Chan, David T Hagerty, Arun J Sanyal. A randomized, placebo-controlled trial of emricasan in patients with NASH and F1-F3 fibrosis. J Hepatol 2020 May;72(5):816-827.
2. Guadalupe Garcia-Tsao, Jaime Bosch, Zeid Kayali, Stephen A Harrison, Manal F Abdelmalek, Eric Lawitz, Sanjaya K Satapathy, Marwan Ghabril, Mitchell L Shiffman, Ziad H Younes, Paul J Thuluvath, Annalisa Berzigotti, Agustin Albillos, James M Robinson, David T Hagerty, Jean L Chan, Arun J Sanyal, IDN-6556-14 Investigators(‡). Randomized placebo-controlled trial of emricasan for non-alcoholic steatohepatitis-related cirrhosis with severe portal hypertension. J Hepatol 2020 May;72(5):885-895.
3. Jordi Gracia‐Sancho, Nicolò Manicardi, Martí Ortega‐Ribera, Raquel Maeso‐Díaz, Sergi Guixé‐Muntet, Anabel Fernández‐Iglesias, Diana Hide, Héctor García‐Calderó, Zoe Boyer‐Díaz, Patricia C. Contreras, Alfred Spada, and Jaime Bosch. Emricasan Ameliorates Portal Hypertension and Liver Fibrosis in Cirrhotic Rats Through a Hepatocyte‐Mediated Paracrine Mechanism. Hepatol Commun. 2019 Jul; 3(7): 987–1000.
4. Friedman S L. Hepatic Stellate Cells: Protean, Multifunctional, and Enigmatic Cells of the Liver. Physiol Rev. 2008 January;88(1):125-72.Puche J.E., Saiman Y., Friedman S.L. Hepatic stellate cells and liver fibrosis. Compr. Physiol. 2013;3:1473–1492.
2. Puche J.E., Saiman Y., Friedman S.L. Hepatic stellate cells and liver fibrosis. Compr. Physiol. 2013;3:1473–1492.
3. Elinos-Báez CM, Maldonado V, Meléndez-Zajgla J. Caspasas: Moléculas Inductoras de Apoptosis. Gac Med Mex. 2003;139(5):493–9. .


