TORMENTA DE CITOCINAS Y MICROTROMBOSIS VENOSA EN COVID-19
- Escrito por Dr.Poo
- Publicado en Auto-inmunidad

Revisando las estadísticas de mortalidad de algunos países de Europa, es sorprendente la elevada mortalidad en España e Italia. Por ello, diversos investigadores se han dado a la tarea de tratar de entender qué es lo que realmente esta pasando porque los virus respiratorios usualmente no son tan dañinos. Esto implica que en hospitales universitarios se estudia de manera muy completa a los pacientes afectados. Derivado de este enfoque han salido a la luz que algunos pacientes que fallecen comparten dos grandes hallazgos:
1. Tormenta de citocinas.
2. Micro-trombosis venosa.
 Las citocinas son pequeñas proteínas, consideradas como mediadores moleculares de inflamación, que permiten la comunicación entre las celulas. Cuando llega un agente infeccioso al organismo (por ejemplo el virus COVID-19 al pulmón) se activa una respuesta de las células (liberación de mensajes moleculares) que permite avisar al sistema inmune (la policia de nuestro cuerpo) para emprender una defensa. En este ejemplo, las células de los alveolos pulmonares avisan a los linfocitos y monocitos que circulan entre los capilares (pequeños vasos sanguìneos). Estas señales advierten que hay un intruso en los pulmones y entonces se inicia una gran respuesta que en ocasiones suele ser demasiado intensa, por lo cual se le ha llamado "tormenta de citocinas". Imaginemos que la intensidad de la respuesta equivale a llenar las avenidas y las calles con soldados y patrullas de defensa, impidiendo el paso de las personas y el resto de vehículos que por allí circulan. Se genera entonces un verdadero congestionamiento, que a nivel bioquímico es llamado "hiperinflamación", lo cual afecta la función de las vías respiratorias, es decir dificultando el adecuado proceso ventilatorio. Por ello, poco a poco, algunos pacientes (lo más graves) no pueden respirar por si solos y requieren cuidados en unidades de Terapia Intensiva e incluso algunos requieren ventilación asistida a través de un tubo dentro de sus bronquios a través de los cuales se administra oxígeno. Las "tormentas de citocinas" han sido descritas, no solo en la infección por COVID-19 sino también en Influenza, así como en las otras infecciones virales graves, ya conocidas, como SARS (acrónimo en inglés de Severe Acute Respratory Syndrome) y en MERS (acrónimo en inglés de Middle East Respiratory Syndrome), causadas por diversos tipos de virus CORONA. Adquirió cierta relevancia con la epidemia de Influenza H1N5, del 2005 y es muy conocida por los médicos intensivistas por su relación con casos de sepsis grave (infecciones generalmente de origen bacteriano). También se ha descrito en el contexto de enfermedades no infecciosas, como la pancreatitis aguda grave, necrótica, hemorrágica. Las tormentas de citocinas incluyen a los siguientes mediados moleculares:
Las citocinas son pequeñas proteínas, consideradas como mediadores moleculares de inflamación, que permiten la comunicación entre las celulas. Cuando llega un agente infeccioso al organismo (por ejemplo el virus COVID-19 al pulmón) se activa una respuesta de las células (liberación de mensajes moleculares) que permite avisar al sistema inmune (la policia de nuestro cuerpo) para emprender una defensa. En este ejemplo, las células de los alveolos pulmonares avisan a los linfocitos y monocitos que circulan entre los capilares (pequeños vasos sanguìneos). Estas señales advierten que hay un intruso en los pulmones y entonces se inicia una gran respuesta que en ocasiones suele ser demasiado intensa, por lo cual se le ha llamado "tormenta de citocinas". Imaginemos que la intensidad de la respuesta equivale a llenar las avenidas y las calles con soldados y patrullas de defensa, impidiendo el paso de las personas y el resto de vehículos que por allí circulan. Se genera entonces un verdadero congestionamiento, que a nivel bioquímico es llamado "hiperinflamación", lo cual afecta la función de las vías respiratorias, es decir dificultando el adecuado proceso ventilatorio. Por ello, poco a poco, algunos pacientes (lo más graves) no pueden respirar por si solos y requieren cuidados en unidades de Terapia Intensiva e incluso algunos requieren ventilación asistida a través de un tubo dentro de sus bronquios a través de los cuales se administra oxígeno. Las "tormentas de citocinas" han sido descritas, no solo en la infección por COVID-19 sino también en Influenza, así como en las otras infecciones virales graves, ya conocidas, como SARS (acrónimo en inglés de Severe Acute Respratory Syndrome) y en MERS (acrónimo en inglés de Middle East Respiratory Syndrome), causadas por diversos tipos de virus CORONA. Adquirió cierta relevancia con la epidemia de Influenza H1N5, del 2005 y es muy conocida por los médicos intensivistas por su relación con casos de sepsis grave (infecciones generalmente de origen bacteriano). También se ha descrito en el contexto de enfermedades no infecciosas, como la pancreatitis aguda grave, necrótica, hemorrágica. Las tormentas de citocinas incluyen a los siguientes mediados moleculares:
- Interferones: regulación de la actividad de defensa natural y efecto antiviral. Destaca los interferones gama.
- Interleucinas: promueven el crecimiento y maduración de los leucocitos (nuestras células de defensa). De las más afectadas son la IL-1, IL-6 e IL-7.
- Quimiocinas: pequeñas proteínas, secretadas por células, que modulan el sistema inmunitario, con función quimioatrayente, es decir que juegan un papel vital en la migración celular a través de las vénulas de la sangre hacia los tejidos y viceversa, y en la inducción del movimientos celular en respuesta a un gradiente químico (quimiocina) por un proceso denominado quimiotaxis. Son necesarias para el reclutamiento de leucocitos, control de la inflamación.
- Factores estimuladores de colonias celulares: estimulación de la médula osea para producir más células. Destaca el factor estimulante de colonias de granulocitos (GCSF).
- Factor de necrosis tumoral (en inglés TNF): activan linfocitos citotóxicos capaces de inactivar a las células que contengan virus.
En un estudio con 154 pacientes de Wuham China, liderado por el Dr. Ruan, destaca como factor predictivo de mortalidad los valores elevado de Ferritina (promedio de 1297 ng/ml en los que no sobreviven contra 614 ng/ml en los que si sobreviven; p<0·001) y de IL-6 (p<0·0001), sugiriendo que la alevada mortalidad puede deverse a una hiperinflamación inducida por el virus.
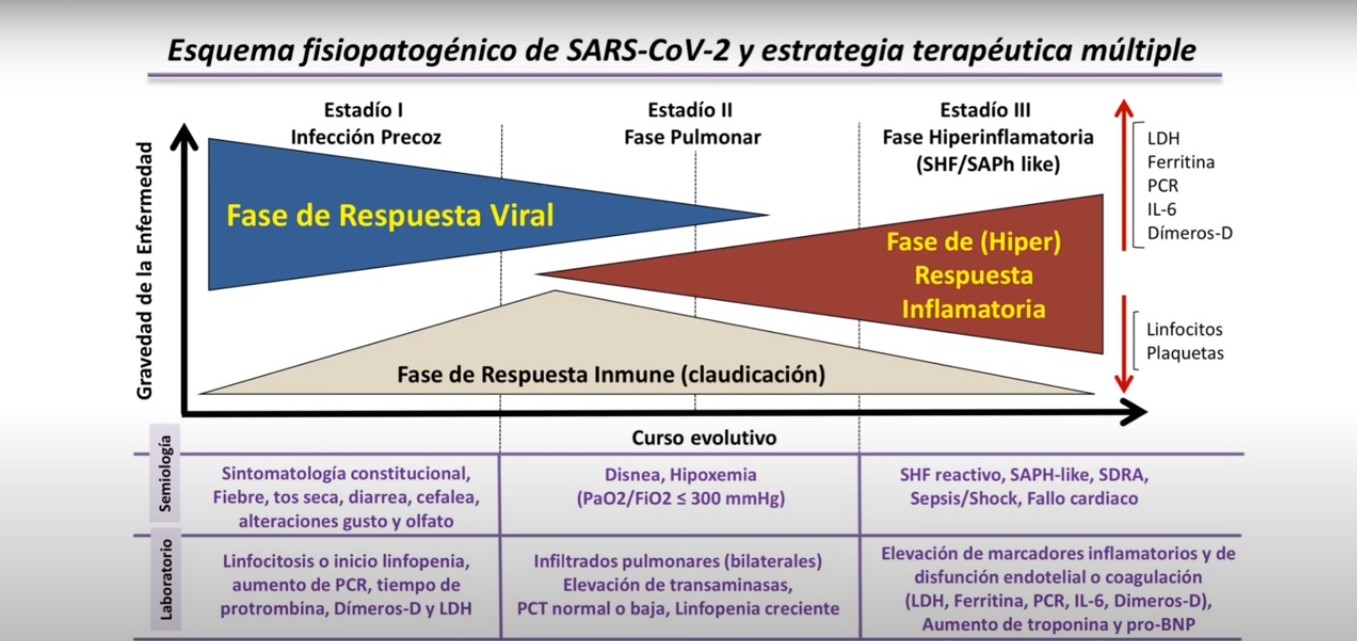
En cuanto a la "Trombosis Pulmonar", diversos estudios han demostrado la presencia de daño al endotelio vascular. Una hipótesis del mecanismo de daño menciona que la hipoxia (falta de oxígeno en los tejidos) genera un incremento de la viscosidad de la sangre, lo cual puede favorecer la adherencia de plaquetas y por lo tanto la trombosis.
Otro estudio de investigadores también de Wuham, liderados por el Dr. Huang, con 449 pacientes, demostraron que el Dimero D (un factor asociado a mayor riesgo de trombosis) se encontraba elevado hasta 6 veces por arriba de lo normal. Se dividieron a los pacientes en un grupo tratado con heparina, un potente anticoagulante (n=90), por al menos 7 días y el resto de la población sin heparina. También se consideró una separación de la población por presencia de coagulopatía inducida por sepsis (en inglès abreviado como SIC). Bueno, pues en el grupo con SIC y puntaje mayor de 4, tratados con heparina, la mortalidad resultó ser significativamente menor que el otro grupo sin tratamiento (40.0% vs 64.2%, P=0.029). Cuando se estratificó a los pacientes por incremento del Dimero-D > 6 veces el valor límite de lo normal, se encontró mejoría en los que recibían heparina (32.8% vs 52.4%, P=0.017).
Por otro lado, una publicación reciente de investigadores suizos, de la ciudad de Lausana, encabezados por el Dr. Rotzinger, menciona que en Angiotomografía pulmonar se puede detectar trombosis pulmonar en pacientes con COVID-19, lo cual puede pasar desapercibido si solo se toma un tomografía simple de tórax, sin contraste intravenoso. Por cierto, esta práctica es la más frecuente en los hospitales que atienden pacientes con COVID-19. Es decir, se toma Tele de Tórax y se toma Tomografía simple. Los autores invitan a considerar la realización de esta prueba, por su mayor utilidad diagnótica y pronóstica.
Otros investigadores de EEUU, encabezados por la Dra. Cynthia Magro, de la Universidad de Wiell Cornell, en Nueva York, describen a 5 pacientes en los cuales detectan cambios de neumonitis, con inflamación significativa del tabique capilar, con depósito de fibrina, presencia de neutrófilos en los tabiques inter-alveolares y presencia de una proteína llamada "complemento", todo ello compatible con micro-trombosis.
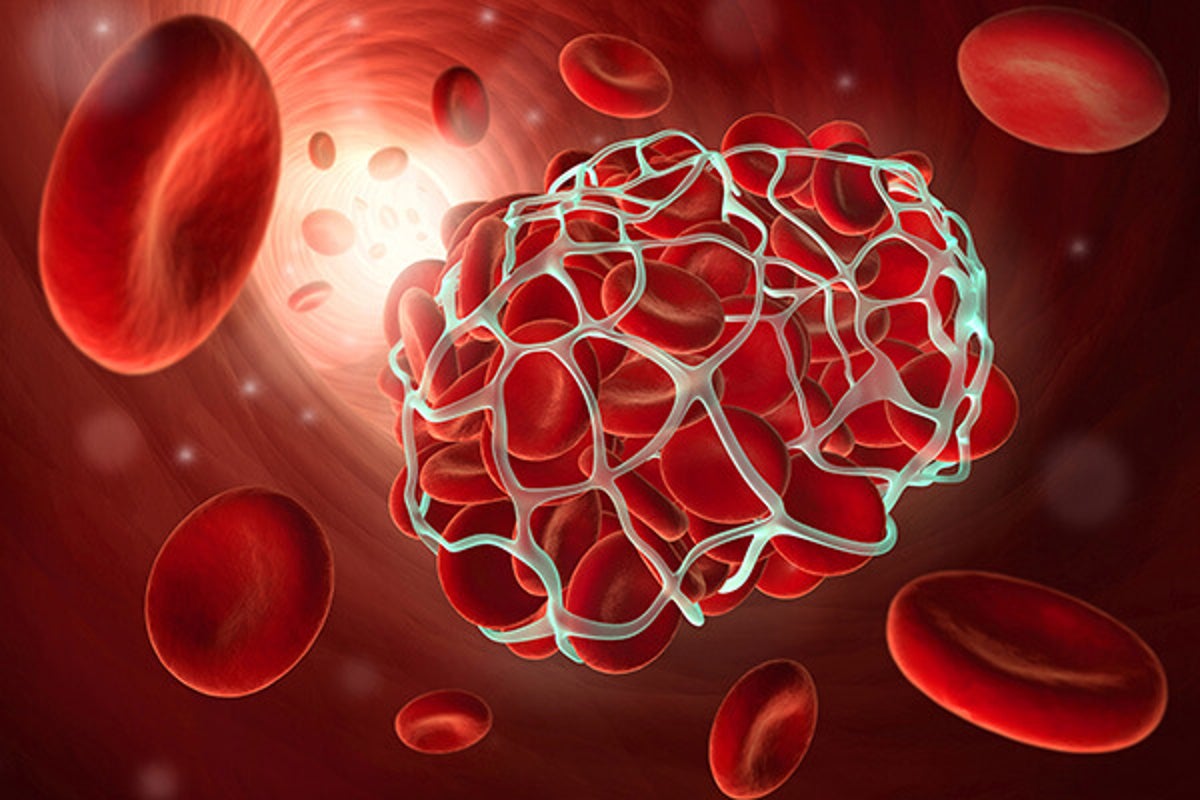 Finalmente, un grupo de investigadores de Milano, Italia, encabezados por el Dr. Fabio Ciceri, comentan que existe un síndrome pro-inflamatorio endotelial que ocasiona trombosis venosa. Incluso proponen un nuevo nombre para la enfermedad grave causada por COVID-19 que podría denominarse MicroCLOTS (que en inglés significa microtrombosis, pero a la vez es un acrónimo, que significa Microvascular COVID-19 Lung vessels Obstructive Thromboinflammatory Syndrome). Una propuesta muy audaz que busca cambiar el enfoque de la terapéutica actual.
Finalmente, un grupo de investigadores de Milano, Italia, encabezados por el Dr. Fabio Ciceri, comentan que existe un síndrome pro-inflamatorio endotelial que ocasiona trombosis venosa. Incluso proponen un nuevo nombre para la enfermedad grave causada por COVID-19 que podría denominarse MicroCLOTS (que en inglés significa microtrombosis, pero a la vez es un acrónimo, que significa Microvascular COVID-19 Lung vessels Obstructive Thromboinflammatory Syndrome). Una propuesta muy audaz que busca cambiar el enfoque de la terapéutica actual.
En cuanto a los hallazgos de autopsia, las alteraciones más relevantes se encuentran en el pulmón en donde se describe edema, daño alveolar, hiperplasia de pneumocitos, con infiltrado inflamatorio a base de linfocitos y células gigantes, multinucleadas. A nivel periférico se encuentra pleuritis y pericarditis, con derrame pleural y pericárdico. A nivel hepático se ha descrito estetatosis y daño inflamatorio inespecíficos.
Sin duda urge un tratamiento efectivo y seguro, pero idealmente accesible para toda la población afectada. El enfoque ideal es utilizar antivirales, es decir medicamentos que impidan la replicación del virus o que lo inactiven. En ese sentido existe un gran número de moléculas en estudio, destacando el REMDESIVIR, una molécula de la empresa farmacéutica Gilead, utilizada en el tratamiento de la infección por virus de EBOLA. De hecho, el Dr. Jonathan Grein, del Hospital Cedars Sinai de Los Angeles y un largo grupo de colaboradores, de EEUU, Canadá, Europa y Japón publicaron el pasado 12 de abril, la experiencia de uso compasivo, con esta molécula, aun sin aprobación formal por la FDA. La publicación salió en la prestigiosa revista New England Journal of Medicine, en la cual se menciona que se incluyeron 61 pacientes con infección demostrada por COVID-19. Se encontró mejoría franca en el 68% de 53 pacientes con síntomas graves. Desde el punto de vista de seguridad un 60% de los pacientes presentaron eventos adversos, destacando la elevaciòn de enzimas, diarrea, urticaria, daño renal e hipotensión. Conviene aclarar que es un estudio descriptivo, sin grupo control y que sus resultados deben ser ratificados en un estudio doble-ciego.
A pesar de esta buena noticia, aún existe un gran número de prometedores enfoques terapéuticos que toman en cuenta la "tormenta de citocinas" y más recientemente a la "trombosis venosa pulmonar" que sin duda son una fuerte esperanza de que pronto se controle esta enfermedad de manera efectiva, segura y accesible. Sin embargo, existen algunas implicaciones prácticas que conviene considerar en la evaluación diagnóstica de los pacientes:
1. Se debe considerar a la Tomografía Pulmonar contrastada, es decir a la Angiotomografía, como el método ideal que permite detectar trombosis pulmonar e iniciar una terapia en forma temprana.
2. Se deben evaluar mediadores inflamatorios en los pacientes de riesgo, para saber que tan activado esta su respuesta inflamatoria. Los mediadores más sencillos incluyen a la proteína C reactiva, la velocidad de sedimentación globular, la ferritina y la deshidrogenasa láctica. En los centros que lo dispongan deben medirse citocinas, por ejemplo la IL6 y el TNF.
3. Se debe continuar realizando las mediciones hematológicas habituales que incluyen a la biometrìa hemática, que permite conocer los valores de leucocitos, linfocitos y plaquetas, ya que se ha descrito que las reducciones en esos parámetros pueden tener valor pronóstico. También debe medirse el DIMERO D, una proteína muy conocida por los hematólogos y médicos de Terapia Intensiva y de Medicina Interna, que podría ayudar a identificar a pacienten en quienes conviene prescribir fármacos anti-trombóticos.
Recuerda que la información aqui transmitida debe ser comentada con tu médico tratante y evitar medidas de auto-prescripción que pueden resultar peligrosas.
Referencias:
1. Jennifer R. Tisoncik, Marcus J. Korth, Cameron P. Simmons, Jeremy Farrar, Thomas R. Martin, and Michael G. Katzea. Into the Eye of the Cytokine Storm. Microbiology and Molecular Biology Reviews 2012;76(1:16 –32.
2. Herold T, Jurinovic V, Arnreich C, et al. Level of IL-6 predicts respiratory failure in hospitalized symptomatic COVID-19 patients. BMJ 2020, April 10.
3. Ruan Q Yang K Wang W Jiang L Song J. Clinical predictors of mortality due to COVID-19 based on an analysis of data of 150 patients from Wuhan, China. Intensive Care Med. 2020; (published online March 3.):1-3.
4. Huang C, Wang Y, Li X, et al. Clinical features of patients infectedwith 2019 novel coronavirus in Wuhan, China. Lancet 2020;395(10223):497–506.
5. Hanley B, Lucas SB, Youd E, Swift B, Osborn M. Autopsy in suspected COVID-19 cases.J Clin Pathol. 2020 Mar 20.
6. Osborn M, Lucas S, Stewart R, et al. Autopsy practice relating to possible cases of COVID-19 (2019-nCov, novel coronavirus from China 2019/2020) secondary autopsy practice relating to possible cases of COVID-19 (2019-nCov, novel coronavirus from China 2019/2020), 2020. Available: https://www.rcpath.org/uploads/assets/ Briefing-on-COVID-19-autopsy-Feb-2020.pdf.
7. Rotzinger DC, Beigelman-Aubry C, von Garnier C, Qanadli SD. Pulmonary embolism in patients with COVID-19: Time to change the paradigm of computed tomography. Thromb Res. 2020 Apr 11;190:58-59.
8. Magro C, Mulvey JJ, Berlin D, Nuovo G, Salvatore S, Harp J, Baxter-Stoltzfus A, Laurence J. Complement associated microvascular injury and thrombosis in the pathogenesis of severe COVID-19 infection: A report of five cases. Transl Res. 2020 Apr 15.
9. Ciceri F, Beretta L, Scandroglio AM, Colombo S, Landoni G, Ruggeri A, Peccatori J, D'Angelo A, De Cobelli F, Rovere-Querini P, Tresoldi M, Dagna L, Zangrillo A. Microvascular COVID-19 lung vessels obstructive thromboinflammatory syndrome (MicroCLOTS): an atypical acute respiratory distress syndrome working hypothesis. Crit Care Resusc. 2020 Apr 15. [Epub ahead of print]
10. J. Chen, X. Wang, S. Zhang, et al. Findings of acute pulmonary embolism in COVID- 19 patients. The Lancet Infectious Diseases (3/1/2020),
11. Tang N, Bai H, Chen X, Gong J, Li D, Sun Z.Anticoagulant treatment is associated with decreased mortality in severe coronavirus disease 2019 patients with coagulopathy. J Thromb Haemost. 2020 Mar 27.
12. J. Grein, N. Ohmagari, D. Shin, G. Diaz, E. Asperges, A. Castagna, T. Feldt, G. Green, M.L. Green, F.-X. Lescure, E. Nicastri, R. Oda, K. Yo, E. Quiros-Roldan, A. Studemeister, J. Redinski, S. Ahmed, J. Bernett, D. Chelliah, D. Chen, S. Chihara, S.H. Cohen, J. Cunningham, A. D’Arminio Monforte, S. Ismail, H. Kato, G. Lapadula, E. L’Her, T. Maeno, S. Majumder, M. Massari, M. Mora-Rillo, Y. Mutoh, D. Nguyen, E. Verweij, A. Zoufaly, A.O. Osinusi, A. DeZure, Y. Zhao, L. Zhong, A. Chokkalingam, E. Elboudwarej, L. Telep, L. Timbs, I. Henne, S. Sellers, H. Cao, S.K. Tan, L. Winterbourne, P. Desai, R. Mera, A. Gaggar, R.P. Myers, D.M. Brainard, R. Childs, and T. Flanigan. Compassionate Use of Remdesivir for Patients with Severe Covid-19. New Engl J Med 2020; April 10.