EN PREPARACIÓN A LA VACUNACIÓN CONTRA EL COVID-19
- Escrito por Dr. Jorge Luis Poo
- Publicado en Especialistas

La pandemia del COVID-19 ha obligado a la segregación social y ha estimulado la búsqueda de soluciones a través de una vacuna que sea eficaz y segura. Sin duda urgen medidas que generen confianza en los tomadores de decisiones para abrir nuevamente la economía y permitir el libre tránsito de los seres humanos a través de todos los escenarios de su habitual movilidad sin comprometer demasiado la salud de los ciudadanos. Por ello, desde la sociedad civil organizada (asociaciones mèdicas, sociedad civiles, empresas de servicio, escuelas y universidades) debemos estar preparados no sólo para la llegada de las vacunas, sino seleccionar la mñas apropiada y identificar con anticipación a las poblaciones prioritarias en las campañas de vacunación, asín como en la modalidad ideal de regreso a la vida presencial. En este artìculo te enterarás cuáles son las vacunas más avanzadas y leerás una propuesta de guía de implementación.
A continuación te presentamos nuestro célebre cuadro de avance de vacunas contra la infección por COVID-19, considerando que hay un gran mercado de ciudadanos (8,500 millones para el año 20205) que lo necesita.

Todo inició gracias al logro de descifrar el genoma del Virus COVID-19. Los trabajos para generar una vacuna se iniciaron desde marzo de 2020 y hasta ahora 13 han logrado llegar al nivel de la fase 3. Debido a la complejidad de los requerimientos, es probable que algunas de ellas no logren la aprobación, pero es magnífico que muy pronto podremos estar en condiciones de elegir la mejor opción.
 Es importante aclarar que ninguna de ellas cura la enfermedad. Su función es prevenir, a través de la generación de anticuerpos que usualmente se consideran protectores al momento de que el ser humano se expone al agente infeccioso.
Es importante aclarar que ninguna de ellas cura la enfermedad. Su función es prevenir, a través de la generación de anticuerpos que usualmente se consideran protectores al momento de que el ser humano se expone al agente infeccioso.
Es importante aclarar lo que llamamos el proceso de investigación farmacológica de una vacuna, que suele tardar varios años:
- Fase pre-clínica: primero se realizan estudios a nivel de cultivos celulares. Si las pruebas resultan positivas se procede a realizar estudios en animales de experimentación (usualmente ratones y monos) bajo estrictas reglas éticas del cuidado de los participantes. Hasta el momento se han probado 87 vacunas.
- Fase 1. Primera utilización en el ser humano. Usualmente se realiza en decenas de voluntarios. El enfoque principal es la seguridad clìnica y bioquímica, pero también se busca la capacidad para generar una respuesta inmune. Por ahora, 38 vacunas están en esta fase.
- Fase 2. Se realiza en centenas de participantes (en vacunas suele ser 300 a 1000 sujetos). El objetivo sigue siendo la seguridad, pero el interés se amplia a probar diversas dosis y evaluar su potencia o eficacia para generar una respuesta inmune que usualmente se mide a través de anticuerpos (respuesta inmune humoral) y de cambio en poblaciones de linfocitos de defensa (respuesta inmune celular). Por ahora, 17 vacunas están en esta fase.
- Fase3. Se realiza en miles de participantes. En el caso de vacunas suele ser de 30 a 50 mil individuos. El objetivo es la eficacia y se mantiene la vigilancia de la seguridad. Ell interés se amplia a evaluar la eficacia no solo para generar una respuesta inmune sino también para generar protección en caso de que los sujetos esten expuestos a ambientes de riesgo de contagio. Solo 13 vacunas están en esta fase.
Proceso de revisión de la evidencias: Este proceso suele tardar entre 12 y 18 meses ya que cada nuevo fármaco usualmente dispone de docenas de miles de páginas relacionadas con los diversos estudios pre-clínicos y clínicos realizados. Ha existido casos en los cuales un sólo nuevo fármaco puede llenar un cuarto de 5x4 metros cuadrados de información por leer y analizar. Las agencias de control de medicamentos candidatos a comercialización como la FDA, en los Estados Unidos o la EMA (European Medicine Agency) han mencionado que darán prioridad a aquellas vacunas que demuestren al menos una protección superior al 50% en los voluntarios o participantes.
Aprobación temporal o de uso limitado. Tanto Rusia como China han aprobado algunas vacunas para uso limitados o temporal. Diversos investigadores y revisores de evidencias en seguridad y eficacia consideran esta decisión como muy peligrosa. Se sabe que algunos eventos adversos no ocurren en pequeñas poblaciones (estudios con decenas o centenas de parcitipantes) pero si cuando la población expuesta aumenta. Por ello, usualmente se debe esperar a tener toda la evidencia. Se suele decir que "las cosas en palacio van despacio", pero en la situación actual entre más días pasen más gente fallece o bien el impacto es discapacidad o ausentismo laboral es enorme. Por eso, urge acelerar procesos y a la vez cumplir con las reglas de demostración de seguridad y eficacia.
 Aprobación definitiva para su uso comercial: hasta el momento no se dispone de ninguna vacuna aprobada.
Aprobación definitiva para su uso comercial: hasta el momento no se dispone de ninguna vacuna aprobada.
Dentro de las opciones para acelerar el proceso se ha descrito que pueden correrse la fase 1 y 2 de manera simultánea. Además se puede solicitar una aprobación acelerada, lo cual reduce el tiempo de revisión de manera significativa. También es importantre aclarar que existen situaciones en que una vacuna es puesta en pausa, mientras que se revisan las evidencias de seguridad y se decide si puede o no continuarse con el estudio. Esto ha ocurrido con la vacuna de la Universidad de Oxford, comercializada por la empresa Astra Zeneca.
En relación a su mecanismo de acción, a continuación les presentamos algunos de los fabricantes y nombres de las vacunas más avanzadas:
Vacuna Moderna. Se trata de una empresa de Biotecnología del estado de Massachusetts en los Estados Unidos (EEUU). Se dice que el gobierno de los EEUU ha apoyado los esfuerzos de esta compañía financiando casi 1 billon de dólares para apoyar el desarrollo de esta vacuna. Los estudios se llevan a cabo en los Institutos Nacionales de Salud. Los estudios se iniciaron desde principios del 2020. Esta vacuna se basa el ARN mensajero de la proteína en espiga (spike protein) del virus. Se enfoca a generar anticuerpos contra la proteína en espiga lo cual nos permite eliminar al virus COVID. Se demostró generación de anticuerpos en monos y se completó de manera segura y eficaz las fases 1 y 2. La fase 3 con 30 mil voluntarios se inició el 27-Jul-2020. El 16 de noviembre pasado, Moderna anunció que la vacuna fue 94.5% efectiva. De 95 participantes que enfermaron por COVID, 90 estaban en el brazo del grupo placebo y sólo 5 en el brazo del grupo de vacuna de prueba. Otro hallazgo interesante es que en los participantes en quienes les dió la enfermedad con curso grave, ninguna había recibido la vacuna de prueba y pertenecían al grupo placebo. La vacuna requiere refrigeración a menos 20 grados y costará 21 euros por dosis.
Vacuna Pfizer, Biontech, Fosun Pharma. Su tecnología también utiliza al ARN mensajero de la proteína en espiga. El inicio de sus fases 2/3 fue el 27 de julio de 2020 con 30 mil voluntarios, en diversos paìses de Estados Unidos y Europa, asì como dos países latinoamericanos, Brasil y Argentina. Los resultados de su estudio de Fase 1/2 fueron resumidos por nuestro comitè editorial recientemente: https://www.amhigo.com/actualidades/ultimas-noticias/54-prevencion-e-higado-en-el-mundo/1151-vacuna-para-covid-19-de-pfizer-resultados-de-fase-1-2 El 12 de septiembre anunciaron que se expandía los estudios a 43,000 participantes. En octubre lograron permiso para incluir participantes niños mayores de 12 años en sus estudios. El 9 de noviembre pasado, se reportaron 164 casos con infección por COVID-19, la mayoría de ellos en el brazo placebo. Las empresas anunciaron que su vacuna fue 95% efectiva. Un hallazgo interesante es que la población mayor de 65 años que usualmente tiene menor respuesta inmune también resultó protegia en el 94% de los casos. Adicionalmente, no se reportaron eventos adversos serios. La vacuna requiere refrigeración a menos 70 grados. La vacuna costará 15 euros por dosis.
Vacuna CANSINO Bio. Desarrollada por la empresa Cansino Biologics en colaboración con la Academia de Ciencias Médicas Militares de China. Utiliza una tecnología basada en un vector viral llamado adenovirus Ad5. En mayo completaron sus estudios de fase 1. En julio reportaron su estudio de fase 2, mencionando que la vacuna produce una potente respuesta inmune. Para sorpresa internacional, el 25-Jun-2020 se informó que los militares chinos habían aprobada por un año, de manera temporal, el uso de la vacuna, por considerarse de utilidad pública. Se ignora si la vacuna sería de uso opcional o bien obligatorio para el gremio militar. La empresa anunció que en el mes de agosto se iniciaron los estudios de fase 3, en China y varios países de la región oriente, incluyendo Arabia Saudita, Pakistan y Rusia. Se requiere una dosis.
Vacuna SPUTNIK V. Desarrollada por el Instituto de Investigación de Gamaleya. Utiliza también una tecnología basada en un vector viral llamado adenovirus Ad5 y Ad26. Se iniciaron estudios en el mes de junio. Su estudios de fase 1 y 2 han sido publicados en la prestigiosa revista Lancet y resumido por nuestro comité editorial: https://www.amhigo.com/actualidades/ultimas-noticias/54-prevencion-e-higado-en-el-mundo/1147-seguridad-de-una-vacuna-heterologa-contra-covid-19-con-refuerzo-primario. El 11 de agosto, el Presidente Vladimir Putin anunción que la vacuna había sido aprobada por las autoridades de salud de su país, aun sin disponer de estudios de fase 3. Debido a la crítica internacional, las autoridades de ese país mencionaron que la aprobación era "un certificado de registro condicionado" y sujeto a los resultados de los estudios de fase 3. En la actualidad se estan corriendo estudios en 40,000 voluntarios, incluyendo Emiratos Arabes, India y Venezuela. El 11 de noviembre de 2020, la empresa Gamaleya anunció que basado en resultados preliminares de 20 casos positivos, la vacuna tenía un 92% de eficacia. El 24 de noviembre, en base a resultados de 39 casos que han resultados contagiados, nuevamente reportan una eficacia del 92%. Como ocurre con las vacunas de Moderna, Pfizer y Astra Zeneca, los resultados aún deben ser publicados en una revista científica de revisión por pares y de estandar internacional..
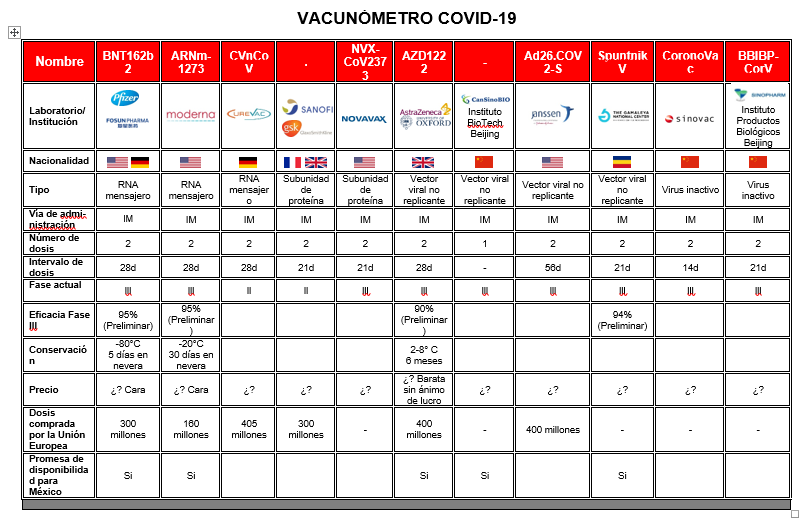
Vacuna AstraZeneca y Universidad de Oxford. Su vacuna se basa en una adenovirus de chimpancé que genera una respuesta de ADN, contra la proteína en espiga (spike protein) del virus. Se demostro generación de anticuerpos en monos y se completó de manera segura y eficaz las fases 1 y 2. Nuestro Comité Editorial también resumió la publicación del primer estudio de esta vacuna en una publicación reciente: https://www.amhigo.com/actualidades/ultimas-noticias/54-prevencion-e-higado-en-el-mundo/1149-seguridad-de-una-vacuna-para-el-covid-19-en-el-reino-unido Los estudios de fase 3 se han llevado a cabo en el Reino Unido y en India. Posteriormente AstraZeneca amplio la participación a Estados Unidos, Brasil y Sudáfrica. El 6 de septiembre la empresa anunció que uno de sus voluntarios había desarrollado una inflamación de la médula espinal, llamada mielitis transversa que provoca parálisis temporal de la mitad del cuerpo y por lo tanto pondría una pausa en su estudio. La paciente se recuperó. En una semana, el estudio se reinició en todos los países, con la excepción de los EEUU. El 21 de octubre, un periódico de Brasil anunció que un voluntario participante había fallecido por COVID19. La empresa farmacéutica no hizo comentarios oficiales y se supuso que el voluntario estaba en el brazo de placebo. El 23-Oct-2020, el subgrupo de participantes de Estados Unidos obtuvo autorización de la FDA para reiniciar el estudio de fase 3. El 19 de noviembre AstraZeneca anunció que los participantes en los grupos mayores de 50, 60 e incluso 70 años desarrollan anticuerpos de protección igual de bien que los sujetos más jovenes. El 23 de noviembre AstraZeneca y a Universidad de Oxford anunciaron resultados basado en 132 casos de infección comentando que la eficacia de la vacuna es superior al 90%. La vacuna requiere 2 dosis y costará alrededor de 3 euros por dosis.
PREPARACIÓN TÉCNICA EN CENTROS DE VACUNACIÓN
Dado que algunas de las vacunas contra COVID que se encuentran en la fase más avanzadas de aprobación requieren de almacenamiento en congelación a menos 70 grados centígrados, los Centros de Vacunación deberán estar equipados con este tipo de ultracongeladores que habitualmente no estan disponibles en varios de ellos. Además, los centros acreditados deberán disponer de una planta de luz de energía propia, así como de los procedimientos que garanticen la adecuada aplicación de la red fría en sus instalaciones. Además, se requiere una sencilla capacitación del personal para implementar sistemas de registro de temperatura, procedimientos de descongelación y de aplicación segura de la vacuna.
POBLACIONES PRIORITARIAS PARA VACUNACIÒN
En fechas reciente, la iniciativa FAIR HEALTH que agrupa a diversos hospitales privados de los EEUU a través del sistema conocido como MEDICARE publicó el informe llamado libro blanco, en el cual reporta la evolución clínica de 467,773 pacientes afectados por COVID-19, desde el mes de marzo en los EEUU (ver nuestro resumen y comentarios del artículo: https://www.amhigo.com/amhiblog/especialistas/jorge-luis-poo/69-amhi-blog/especialistas/1197-las-comorbilidades-y-el-covid En esa publicación se reporta solo un 0.59% de mortalidad general, pero se aclara que diversas poblaciones deben ser consideras como de mayor riesgo. Por ello, consideramos que las poblaciones prioritarían deberán ser las siguientes:
- Pacientes con cáncer, de cualquier edad y en quienes sus condiciones clínicas lo permitan de acuerdo a su médico tratante.,
- Pacientes con padecimientos crónicos (cardiovasculares, metabólicos o degenerativos) que se encuentren en fase avanzada o descontrolada, de cualquier edad.
- Sujetos mayores de 70 años, incluyendo a aquellos que no tengan padecimientos crónicos activos o bien se encuentren en buen control de los mismos
- Sujetos con deficiencias cognitivas (Demencia, Alzheimer, enfermedad vascular cerebral, epilepsia, entre otros).
- Pacientes con discapacidades de cualquier edad.
- Pacientes con trastornos del movimiento, incluyendo padecimientos neurológicos o bien ortopédicos (problemas de columna o cadera) o bien ulceras de presión que los restringen.
- Pacientes con Insuficiencia renal, de cualquier edad.
- Pacientes con cirrosis hepática ya sea en fase compensada o descompensada.
- Pacientes con 3 o más comorbilidades asociadas (por ejemplo Diabetes, màs Hipertensión, más Hiperlipidemia, más Obesidad).
- Niños o adolescentes con deficit físico o cognitivo.
Es importante aclarar, que mientras se activan los programas de Vacunación, todos esos grupos de pacientes deben estar identificados y apoyados en sus estudios de laboratorio o gabinete de rutina, así como programas de consulta virtual o presencial, médica y nutricional, con la adecuada prescripción y dispensación de fármacos que aplican a su padecimiento. Tristemente, en este momento, una alta proporción de instituciones públicas han cancelado la consulta en estos pacientes.
PREPARACIÓN PARA EL REGRESO A LA VIDA LABORAL PRESENCIAL
Las escuelas primarias, secundarias y de bachillerato y nivel universitarios, así como las empresas de servicio que han estado en modalidad virtual deberían tener identificados a sus alumnos y empleados en categorías de riesgo nulo, bajo, moderado o alto, mediante el uso de "calculadoras de riesgo". Una de ellas, con más de 750 mil consultas está disponible en nuestro portal: https://www.amhigo.com/mi-diagnostico/calculadoras/riesgo-de-infeccion-por-covid-19 . Es importante aclarar que las calculadoras orientadas a acumular puntaje basados en edad o bien en número de padecimientos crónicos (como la del IMSS) no toman en cuenta el estado de control del padecimiento y por lo tanto sobrevaloran el riesgo de la población evaluada. Se debe informar a las personas que el tener riesgo NO SIGNIFICA que tengan la enfermedad. Se les aclarará que tienen un mayor riesgo, solo en caso de que llegasen a enfermarse del COVID, lo cual puede no ocurrir si siguen aplicando medidas apropiadas de prevención (comer bien, hacer ejercicio, tomar sus medicamentos y además lavado de manos y uso de cubre-bocas cuando aplique). Al conocerse las categorías de riesgo, las personas que podrían regresar primero serían las de nulo o bajo riesgo, luego las de mediano y finalmente las de alto (una vez que se hayan vacunado). Adicionalmente, en aquellos lugares de trabajo en donde se han reportado pacientes contagiados, se deberá garantizar la cuarentena de 14 días, medirles anticuerpos a partir del día 15 de inicio del padecimiento y darles prioridad al regreso a actividades presenciales. En el sistema de salud gubernamental no de dispone de estas pruebas, por lo cual corresponde a los particulares el realizarla, como una medida para conocer su estado inmune después de haber tenido la infección. De hecho, una de las formas de saber si la vacuna funcionó es que produzca formación de anticuerpos.
En conclusión, se acercan fechas más gratas y de mayor seguridad para todos. Enhorabuena !!!.

Referencias:
1. Consulta del registro de vacunas en desarrollo de la página oficial de la OMS: https://www.who.int/publications/m/item/draft-landscape-of-covid-19-candidate-vaccines
2. Consulta en la página de de la Regulatory Affairs Pofessional Society: https://www.raps.org/news-and-articles/news-articles/2020/3/covid-19-vaccine-tracker
3. Requisitos de la FDA en materia de evaluación de vacunas: https://www.fda.gov/emergency-preparedness-and-response/coronavirus-disease-2019-covid-19/covid-19-vaccines
4. Consulta a la página Health Line: https://www.healthline.com/health-news/heres-exactly-where-were-at-with-vaccines-and-treatments-for-covid-19#Antivirals
5. Consulta a la página de FAIR HEALTH: https://www.fairhealth.org/publications/whitepapers
