SOBRE EL ORÍGEN DE LA HEPATITIS AUTOINMUNE
- Escrito por Dr. Jorge Luis Poo
- Publicado en Auto-inmunidad
A los Hepátologos suele llegarnos pacientes con Hepatitis de causa desconocida. Es decir, los pacientes niegan la ingesta de alcohol, los marcadores virales son negativos y no existen enfermedades metabólicas asociadas. Entonces solicitamos pruebas inmunológicas y salen positivas. Solicitamos una biopsia o bien utilizamos una calculadora específica de Hepatitis Autoinmune (en adelante abreviado como HAI) y sale con puntaje de probable o definitiva. Entonces, los pacientes, de predominio mujeres, nos preguntan ¿Porqué me dió esta enfermedad?. En este artículos, entérate de las teorías que explican esta enfermedad.
Introducción:
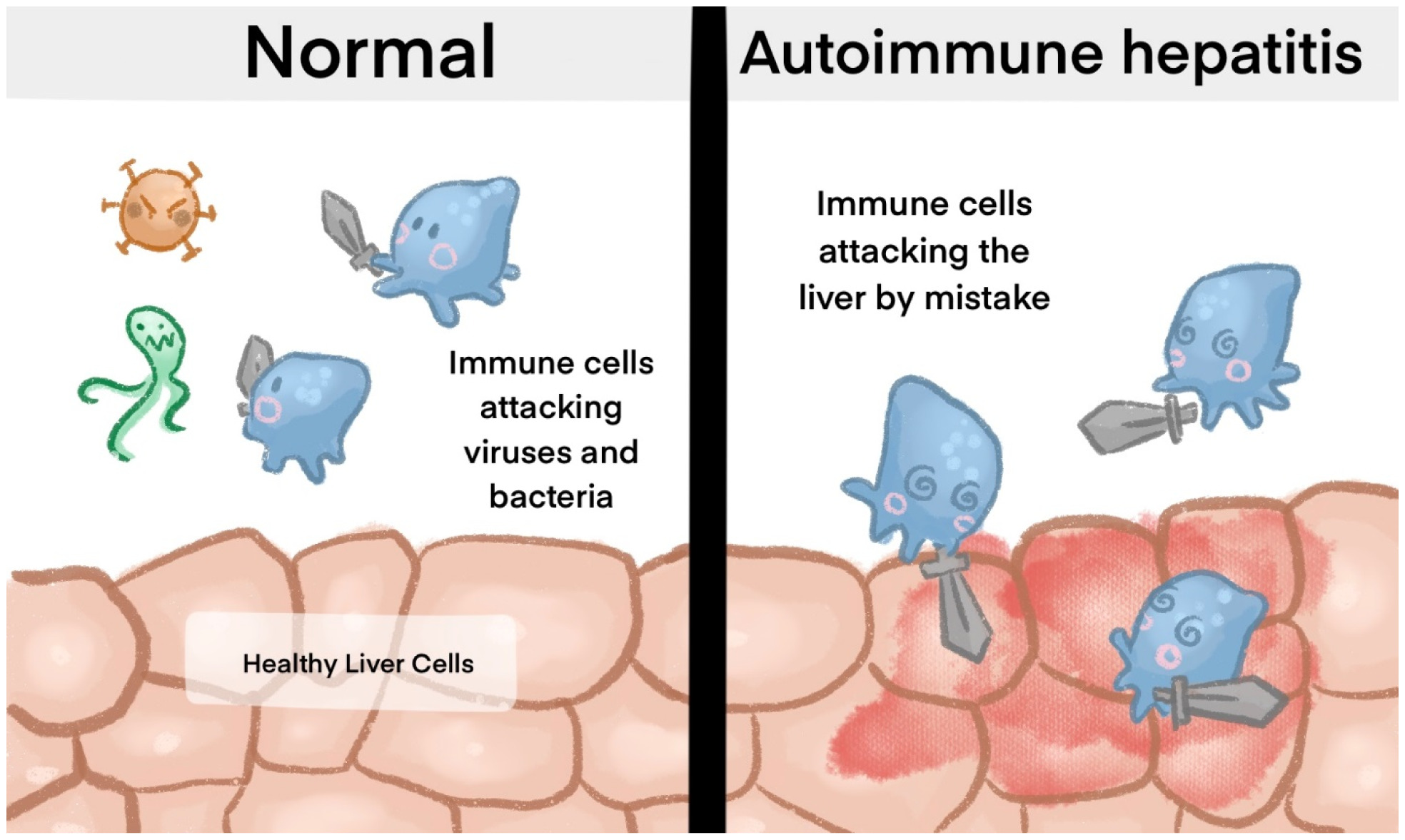
La HAI es una enfermedad hepática crónica de origen autoinmune en la que el sistema inmunológico del cuerpo ataca erróneamente las células del hígado, provocando inflamación y daño hepático. Aunque la causa exacta de la HAI sigue siendo desconocida, se cree que varios factores contribuyen al desarrollo de esta enfermedad. En este artículo, examinaremos los factores causales de la hepatitis autoinmune.

Factores Genéticos
Los estudios han demostrado que la predisposición genética desempeña un papel importante en el desarrollo de la hepatitis autoinmune. Se ha observado que la enfermedad tiende a ser más común en individuos con antecedentes familiares de trastornos autoinmunes, como la artritis reumatoide o el lupus eritematoso sistémico. .
Los estudios de epidemiología y genética han proporcionado evidencia sólida de que la predisposición genética desempeña un papel importante en la susceptibilidad a la HAI. Se ha observado que la enfermedad tiende a agruparse en familias y tiene una mayor prevalencia en ciertas poblaciones étnicas, lo que sugiere una base genética. Además, estudios de gemelos han demostrado que existe una mayor concordancia en gemelos idénticos en comparación con gemelos no idénticos, lo que respalda la influencia genética en el desarrollo de la HAI.
Uno de los hallazgos genéticos más significativos en la HAI está relacionado con los alelos del complejo principal de histocompatibilidad (MHC). El MHC, en particular el HLA-DRB1, se ha asociado fuertemente con la susceptibilidad a la HAI. Estudios han revelado que ciertos alelos HLA-DRB1, como el DRB103 y el DRB104, aumentan el riesgo de desarrollar la enfermedad. Estos alelos están involucrados en la presentación de antígenos a las células T y juegan un papel clave en la regulación de la respuesta inmunológica.
Además del MHC, varios otros genes han sido identificados como contribuyentes a la susceptibilidad a la HAI. Genes como el PTPN22, el CTLA4 y el FOXP3 están involucrados en la regulación de la respuesta inmunológica y la tolerancia inmunológica. Variantes genéticas en estos genes pueden predisponer a un individuo a una respuesta inmunológica inapropiada que resulta en la HAI.
Factores Ambientales
Aunque la genética juega un papel importante, se cree que los factores ambientales también desempeñan un papel en el desarrollo de la HAI. Algunos de estos factores pueden desencadenar una respuesta autoinmune en individuos genéticamente predispuestos. Los posibles desencadenantes ambientales incluyen infecciones virales, como el virus de la hepatitis C o más recientemente el virud de COVID-19, ciertos medicamentos y otros factores ambientales aún no identificados.
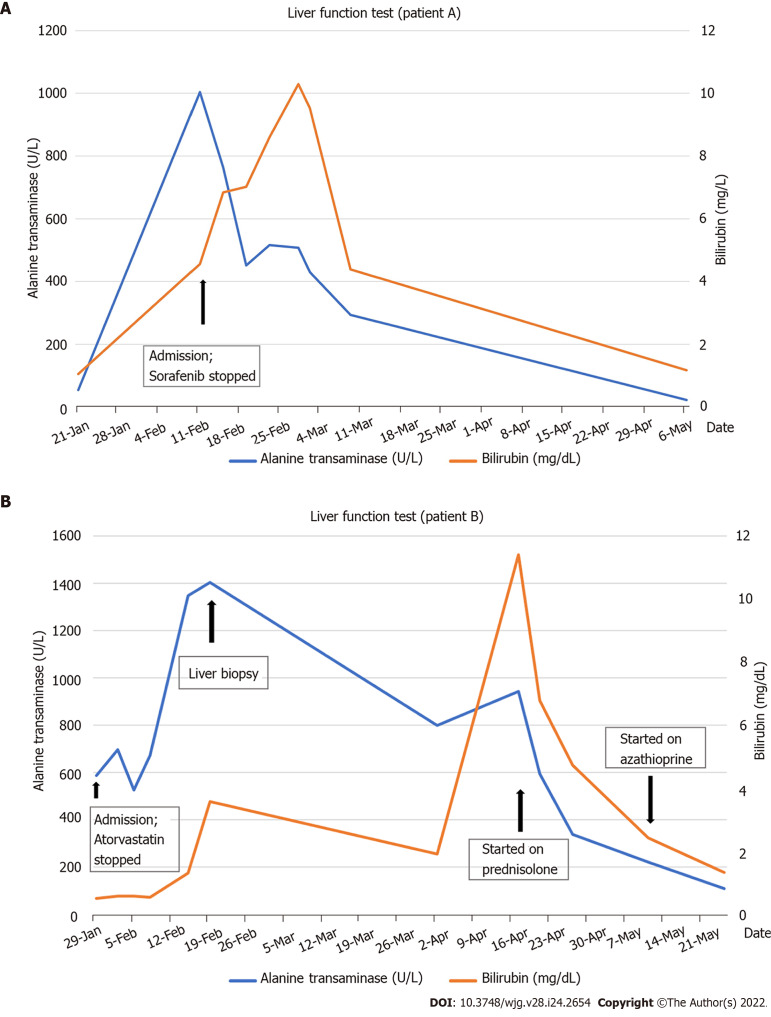
La HAI desencadenada por fármacos (HAIDF) es un fenómeno poco común pero importante a tener en cuenta, ya que puede desencadenar síntomas graves de hepatitis autoinmune en individuos previamente sanos. Los medicamentos que se han asociado con HAIDF se clasifican en aquellos con asociación definitiva (p. ej., minociclina, nitrofurantoína, infliximab), asociación probable (p. ej., diclofenaco, atorvastatina, rosuvastatina, etanercept) y posible asociación, como es el caso del Sorafenif, un agente antineoplásico, según algunos casos informados . como se resume en la Guía de práctica de AIH de la Sociedad Estadounidense de Enfermedades Hepáticas más reciente. A continuación se describe un ejemplo de elevación de la enzima ALT o TGP, así como de las bilirrubinas totales, asociado a la ingesta del medicamento Sorafenib y a la Atorvastatina. En el primer caso al suspenderse el fármaco involucrado se observa una mejoría en las alteraciones bioquímicas; en el segundo caso es necesario agregar prednisona y luego azatioprina, dos fármacos usualmente utilizado para tratar esta enfermedad.
Algunos de los medicamentos con asociación definitiva con la HAIDF incluyen:
- Minociclina: La minociclina es un antibiótico comúnmente utilizado para tratar infecciones bacterianas, como el acné. Se ha informado que el uso prolongado de minociclina puede desencadenar la HAIDF en algunos pacientes, aunque no se comprende completamente por qué esto sucede.
- Nitrofurantoína: La nitrofurantoína es un antibiótico utilizado para tratar infecciones del tracto urinario. Al igual que con la minociclina, se ha observado que su uso prolongado puede inducir la HAIDF en ciertos individuos.
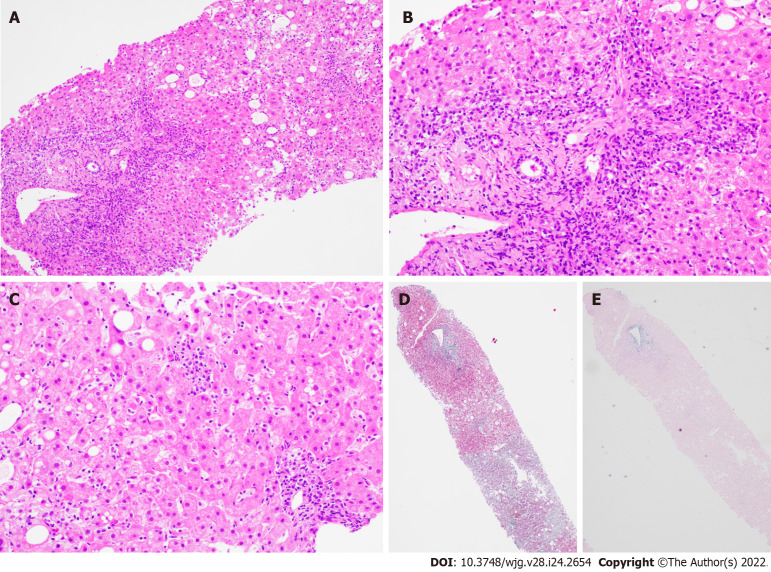
Es importante destacar que no todas las personas que toman estos medicamentos desarrollan HAIDF, y la razón exacta por la que algunos individuos son susceptibles mientras que otros no lo son aún no se comprende completamente. El mecanismo exacto por el cual estos medicamentos inducen la HAIDF no se ha esclarecido por completo, pero se cree que involucra una respuesta inmunológica anormal. Se ha sugerido que estos fármacos pueden actuar como haptenos, sustancias que se unen a proteínas en el cuerpo y provocan una respuesta inmunológica. A continuación se presentan microfotografías de una biopsia hepática, con componente inflamatorio a base de linfocitos que afectan al llamado lobulillo hepático y que es la base del daño crónico al hígado.
Factores Hormonales
Se ha observado que la HAI afecta con mayor frecuencia a mujeres que a hombres, lo que sugiere un posible papel de los factores hormonales en la enfermedad. Se ha especulado que las hormonas sexuales, como los estrógenos, pueden influir en la respuesta inmunológica y contribuir al desarrollo de la HAI. Sin embargo, se necesita más investigación para comprender completamente esta relación.
Los estrógenos, hormonas sexuales femeninas, han sido objeto de atención en la investigación de enfermedades autoinmunes debido a la marcada prevalencia de estas afecciones en mujeres en edad reproductiva. Se ha observado que los estrógenos pueden tener efectos tanto proinflamatorios como antiinflamatorios en el sistema inmunológico.
Por un lado, se ha demostrado que los estrógenos aumentan la producción de citocinas proinflamatorias y promueven la activación de células inmunitarias, lo que puede agravar las enfermedades autoinmunes. Por otro lado, los estrógenos también pueden tener un efecto protector al mejorar la respuesta inmunológica contra infecciones y reducir la inflamación en ciertos contextos.
La Importancia de la Prolactina
La prolactina, una hormona producida por la glándula pituitaria anterior, también ha sido asociada con enfermedades autoinmunes. Se ha observado que niveles elevados de prolactina están relacionados con una mayor susceptibilidad a enfermedades autoinmunes como el lupus eritematoso sistémico y la esclerosis múltiple. La prolactina puede influir en la función inmunológica al estimular la producción de anticuerpos y promover la inflamación.
Efectos de las Hormonas en la Tolerancia Inmunológica
La tolerancia inmunológica es un proceso crucial para prevenir respuestas inmunológicas inapropiadas contra el propio cuerpo. Se ha sugerido que las hormonas sexuales, como los estrógenos, pueden influir en la tolerancia inmunológica al afectar la función de las células T reguladoras (Tregs), que son responsables de mantener la autorregulación del sistema inmunológico. Una disfunción en estas células podría contribuir al desarrollo y la exacerbación de enfermedades autoinmunes.
Relación entre la Tiroides y la enfermedades hepáticas
Existe una relación compleja entre la tiroides y el hígado en la salud y la enfermedad. El hígado desempeña un papel fisiológico esencial en la activación e inactivación, el transporte y el metabolismo de la hormona tiroidea. Por el contrario, las hormonas tiroideas afectan las actividades de los hepatocitos y el metabolismo hepático. Las anomalías de las enzimas hepáticas séricas observadas en el hipotiroidismo pueden estar relacionadas con un metabolismo lipídico alterado, esteatosis hepática o miopatía inducida por el hipotiroidismo. El hipotiroidismo grave puede tener características bioquímicas y clínicas, como hiperamonemia y ascitis, que imitan las de la insuficiencia hepática.
Las pruebas de función hepática suelen ser anormales también en el hipertiroidismo, debido al estrés oxidativo, la colestasis o el aumento de la actividad osteoblástica. La hepatotoxicidad asociada a fármacos antitiroideos es un evento poco común, probablemente relacionado principalmente con un mecanismo idiosincrásico, que va desde un daño hepatocelular leve hasta insuficiencia hepática. El daño hepático inducido por propiltiouracilo suele ser más grave que el causado por metimazol. Por otro lado, las anomalías de la tiroides se pueden encontrar en enfermedades hepáticas, como la hepatitis C crónica, la cirrosis hepática, el carcinoma hepatocelular y el colangiocarcinoma.
En particular, las enfermedades autoinmunes de la tiroides se encuentran con mayor frecuencia en pacientes con infección por el virus de la hepatitis C. Estos pacientes, especialmente si preexiste autoinmunidad tiroidea, tienen riesgo de hipotiroidismo o, con menor frecuencia, tirotoxicosis, durante y después del tratamiento con interferón alfa solo o en combinación con ribavirina, comúnmente utilizado antes de la introducción de nuevos fármacos antivirales.
Efectos del Estrés en el Sistema Inmunológico
El estrés crónico puede tener efectos perjudiciales en el sistema inmunológico. El sistema de respuesta al estrés, conocido como el eje hipotalámico-pituitario-adrenal (HPA), libera hormonas como el cortisol en respuesta al estrés. El cortisol, cuando se produce en exceso debido al estrés crónico, puede tener efectos supresores sobre el sistema inmunológico, debilitando la respuesta inmunitaria normal del cuerpo. Esto puede hacer que el organismo sea más susceptible a infecciones y, en el caso de las enfermedades autoinmunes, puede agravar la respuesta inmunológica anormal que caracteriza a estas condiciones.
Aunque la relación entre el estrés y las enfermedades autoinmunes aún está siendo investigada, se han realizado estudios que sugieren una asociación. Por ejemplo, investigaciones han encontrado que el estrés crónico puede desencadenar brotes o empeorar los síntomas en enfermedades autoinmunes como el lupus eritematoso sistémico y la artritis reumatoide. Además, se ha observado que el estrés puede influir en la expresión de genes relacionados con la inflamación y la autoinmunidad.
Se cree que el estrés puede influir en las enfermedades autoinmunes a través de múltiples mecanismos. Además de su impacto en el sistema inmunológico, el estrés crónico también puede alterar la permeabilidad intestinal, lo que podría contribuir a la activación de respuestas autoinmunes. Además, el estrés puede llevar a cambios en el microbioma intestinal, que se ha relacionado con algunas enfermedades autoinmunes.
A diferencia de otras enfermedades autoinumnes, como el Lupus Eritematoso o la Artritis Reumatoide, en el caso de la HAI no se ha descrito relación específica entre el nivel de estrés y su aparición.
Algunos autores, como Katja Biever y colaboradores de la Universidad de Lübeck, en Alemania, mencionan que aproximadamente el 5% de la población mundial se ve afectada por enfermedades autoinmunes. En general, las enfermedades autoinmunes siguen siendo difíciles de tratar, imponen una gran carga a los pacientes y tienen un impacto económico significativo. Al igual que otras enfermedades complejas, por ejemplo el cáncer, las enfermedades autoinmunes se desarrollan a lo largo de varios años.
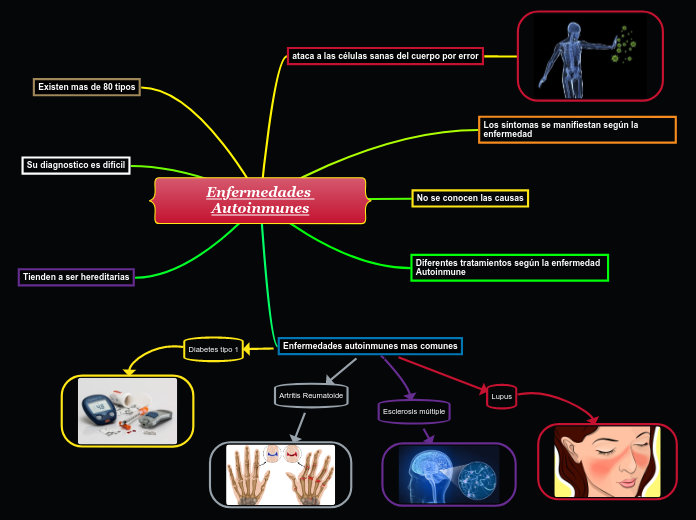
Los pasos decisivos en el desarrollo de enfermedades autoinmunes son (i) el desarrollo de linfocitos específicos de autoantígeno y (a menudo) autoanticuerpos y (ii) la manifestación potencialmente clínica de la enfermedad en una etapa posterior. Sin embargo, no todos los individuos sanos con autoanticuerpos desarrollan manifestaciones de la enfermedad. La identificación de individuos sanos con autoanticuerpos positivos y el seguimiento e inhibición de su cambio a enfermedades autoinmunes inflamatorias se encuentran actualmente en su infancia.
El cambio de respuestas de autoanticuerpos y células T y B específicas de autoantígenos inofensivos a respuestas inflamatorias parece ser el sello distintivo del factor decisivo en las enfermedades autoinmunes inflamatorias. En consecuencia, los biomarcadores que nos permitan predecir esta progresión tendrían un impacto significativo. Varios factores, como la genética y el medio ambiente, especialmente la dieta, el tabaquismo, la exposición a contaminantes, las infecciones, el estrés y el trabajo por turnos, podrían influir en la progresión de enfermedades autoinmunes inofensivas a enfermedades autoinmunes inflamatorias.

Otro estudio realizado en Taiwan, por el Dr. Tien-Wei Hsu y colaboradores, de diversos hospitales psiquiátricos en la ciudad de Taipei, que incluyeron a 5273 pacientes con estrés post-traumático (TEPT), así como controles emparejados 1:4 permitió realizar un seguimiento de los sujetos por al menos 10 años o hasta su muerte. Las enfermedades autoinmunes investigadas incluyeron tiroiditis, lupus, artritis reumática, enfermedad inflamatoria intestinal, síndrome de Sjogren, dermatomiositis y polimiositis. Después de ajustar por factores de confusión, los pacientes con TEPT tenían un riesgo 2.26 veces mayor de desarrollar cualquier enfermedad autoinmune (reportado como índices de riesgo con intervalos de confianza del 95%: 1,82-2,80) que los controles.
Para enfermedades autoinmunes específicas, los pacientes con trastorno de estrés postraumático tenían un riesgo 2,70 veces mayor (1,98-3,68) de tiroiditis, un riesgo 2,95 veces mayor (1,20-7,30) de lupus y un riesgo 6,32 veces mayor (3,44-11,60) de Síndrome de Sjogren. Además, la gravedad del trastorno de estrés postraumático se asoció con el riesgo de enfermedades autoinmunes de forma dosis dependiente. Es decir, los paciente con mayor necesidad de atención en clínicas psiquiátricas se asociaron con un riesgo 8,23 veces mayor (6,21-10,90) de cualquier enfermedad autoinmune que los controles.
Conclusión
La hepatitis autoinmune es una enfermedad hepática crónica que involucra una interacción compleja de factores genéticos, ambientales, inmunológicos y posiblemente hormonales. Aunque se han realizado avances significativos en la comprensión de esta enfermedad, todavía hay mucho por descubrir. La identificación de los factores causales de la HAI es esencial para el desarrollo de enfoques de diagnóstico temprano y tratamiento efectivo. Se necesita una investigación continua para mejorar nuestra comprensión de esta enfermedad y mejorar la calidad de vida de los pacientes con HAI.
Aunque se necesita más investigación para comprender completamente la relación entre el estrés y las enfermedades autoinmunes, existe evidencia creciente que sugiere que el estrés crónico puede desempeñar un papel en la aparición y exacerbación de estas condiciones. Los mecanismos subyacentes aún no se comprenden por completo, pero la conexión entre el estrés y el sistema inmunológico ofrece un área emocionante para la investigación futura. Dada la importancia del estrés en la salud general, la gestión efectiva del estrés puede ser beneficiosa para las personas con enfermedades autoinmunes como parte de su enfoque de tratamiento integral.
Referencias bibliográficas:
- Hsu TW, Bai YM, Tsai SJ, Chen TJ, Chen MH, Liang CS. Risk of autoimmune diseases after post-traumatic stress disorder: a nationwide cohort study. Eur Arch Psychiatry Clin Neurosci. 2023 Jun 15. doi: 10.1007/s00406-023-01639-1. Epub ahead of print. PMID: 37322294.
- Bieber K, Hundt JE, Yu X, Ehlers M, Petersen F, Karsten CM, Köhl J, Kridin K, Kalies K, Kasprick A, Goletz S, Humrich JY, Manz RA, Künstner A, Hammers CM, Akbarzadeh R, Busch H, Sadik CD, Lange T, Grasshoff H, Hackel AM, Erdmann J, König I, Raasch W, Becker M, Kerstein-Stähle A, Lamprecht P, Riemekasten G, Schmidt E, Ludwig RJ. Autoimmune pre-disease. Autoimmun Rev. 2023 Feb;22(2):103236.
- Mack CL, Adams D, Assis DN, Kerkar N, Manns MP, Mayo MJ, Vierling JM, Alsawas M, Murad MH, Czaja AJ. Diagnosis and Management of Autoimmune Hepatitis in Adults and Children: 2019 Practice Guidance and Guidelines From the American Association for the Study of Liver Diseases. Hepatology. 2020;72:671–722.
- Tan CK, Ho D, Wang LM, Kumar R. Drug-induced autoimmune hepatitis: A minireview. World J Gastroenterol. 2022 Jun 28;28(24):2654-2666.
- Piantanida E, Ippolito S, Gallo D, Masiello E, Premoli P, Cusini C, Rosetti S, Sabatino J, Segato S, Trimarchi F, Bartalena L, Tanda ML. The interplay between thyroid and liver: implications for clinical practice. J Endocrinol Invest. 2020 Jul;43(7):885-899.
- Glaser, R., & Kiecolt-Glaser, J. K. (2005). Stress-induced immune dysfunction: Implications for health. Nature Reviews Immunology, 5(3), 243-251.
- Dhabhar, F. S. (2014). Effects of stress on immune function: the good, the bad, and the beautiful. Immunologic Research, 58(2-3), 193-210.
- Straub, R. H., & Cutolo, M. (2016). Involvement of the hypothalamic–pituitary–adrenal/gonadal axis and the peripheral nervous system in rheumatoid arthritis: viewpoint based on a systemic pathogenetic role. Arthritis & Rheumatology, 68(2), 256-261.
- Zaja, A. J. (2015). Genetics in autoimmune hepatitis. Digestive Diseases, 33(Suppl 2), 13-24.
- Hirschfield, G. M., & Vergani, D. (2011). The immunogenetics of autoimmune hepatitis. Journal of Autoimmunity, 37(3), 179-190.
- Liberal, R., Longhi, M. S., Mieli-Vergani, G., & Vergani, D. (2016). Pathogenesis of autoimmune hepatitis. Best Practice & Research Clinical Gastroenterology, 30(3), 331-343.
- Cutolo, M., Capellino, S., Sulli, A., Seriolo, B., & Straub, R. H. (2004). Estrogens and autoimmune diseases. Annals of the New York Academy of Sciences, 1037(1), 38-56.
- Cervera, R., Khamashta, M. A., Font, J., Sebastiani, G. D., Gil, A., Lavilla, P., ... & Hughes, G. R. (1992). Morbidity and mortality in systemic lupus erythematosus during a 10-year period: a comparison of early and late manifestations in a cohort of 1,000 patients. Medicine, 71(5), 291-298.
El autor de este resumen, Dr. Jorge Luis Poo, reconoce el uso parcial de la tecnología Chat GPT para la elaboración de este artículo de divulgación del conocimiento.