ANTIVIRAL SEGURO Y EFECTIVO EN EL TRATAMIENTO DE LA INFECCIÓN POR VIRUS DE HEPATITIS C DURANTE EL EMBARAZO
- Escrito por Dra. Juanita Pérez
- Publicado en Hepatitis virales
En 2015, la Organización Mundial de la Salud estimó que 71.1 millones de personas estaban infectadas con el virus de la hepatitis C (VHC), con 1.75 millones de nuevas infecciones. El uso de drogas inyectables entre las personas en edad reproductiva es la causa principal de estas nuevas infecciones por el VHC y ha resultado en un aumento dramático en la prevalencia este padecimiento entre mujeres embarazadas.
El embarazo es un período crucial de participación en la atención de la salud, y el tratamiento del VHC durante el embarazo no solo curaría la infección materna por VHC, sino que también podría prevenir la transmisión perinatal y la futura transmisión comunitaria del virus. Usualmente la placenta los protege, pero al momento del parto puede existir paso de la sangre infectada de la mamá al bebé.
Históricamente, el tratamiento del VHC durante el embarazo no fue posible porque el tratamiento incluía interferón pegilado y ribavirina, que tienen una alta toxicidad, efectos secundarios sustanciales y riesgos de malformación en el bebé. En el año 2014 la oficina de Administración de Medicamentos y Alimentos de los Estados Unidos (FDA) y la Agencia Europea de Medicamentos (EMA) aprobaron el uso de la combinación de dosis fija del sofosbuvir y el ledipasvir para el tratamiento del VHC en los pacientes sin tratamiento previo y con antecedentes de tratamiento fallido.
Las mujeres con VHC no recibían tratamiento durante el embarazo porque no había datos sobre la seguridad y eficacia de antivirales de acción directa altamente efectivos durante el período gestacional. Las embarazadas generalmente están excluidas de participar en ensayos clínicos de nuevos medicamentos. Las evaluaciones prospectivas de medicamentos para su uso en el embarazo a menudo se retrasa años después de la aprobación o no se realiza en absoluto.
Ledipasvir-sofosbuvir es un candidato para el tratamiento del VHC durante el embarazo porque los datos preclínicos no mostraron problemas de seguridad cuando se administró a ratas y conejas preñadas a dosis más altas que las utilizadas para tratar el VHC en humanos.
Objetivo
Comparar los parámetros farmacocinéticos de ledipasvir-sofosbuvir administrado a mujeres embarazadas con infección por VHC con los de un grupo histórico de referencia de mujeres no embarazadas con infección por VHC.
 Métodos
Métodos
Este estudio fase 1, es una evaluación farmacocinética de la administración de ledipasvir-sofosbuvir durante el embarazo. El estudio se realizó en un gran hospital de maternidad de atención de tercer nivel, el Magee-Womens Hospital, en Pittsburgh, PA, EE. UU., donse se atienden aproximadamente 10,000 partos cada año.
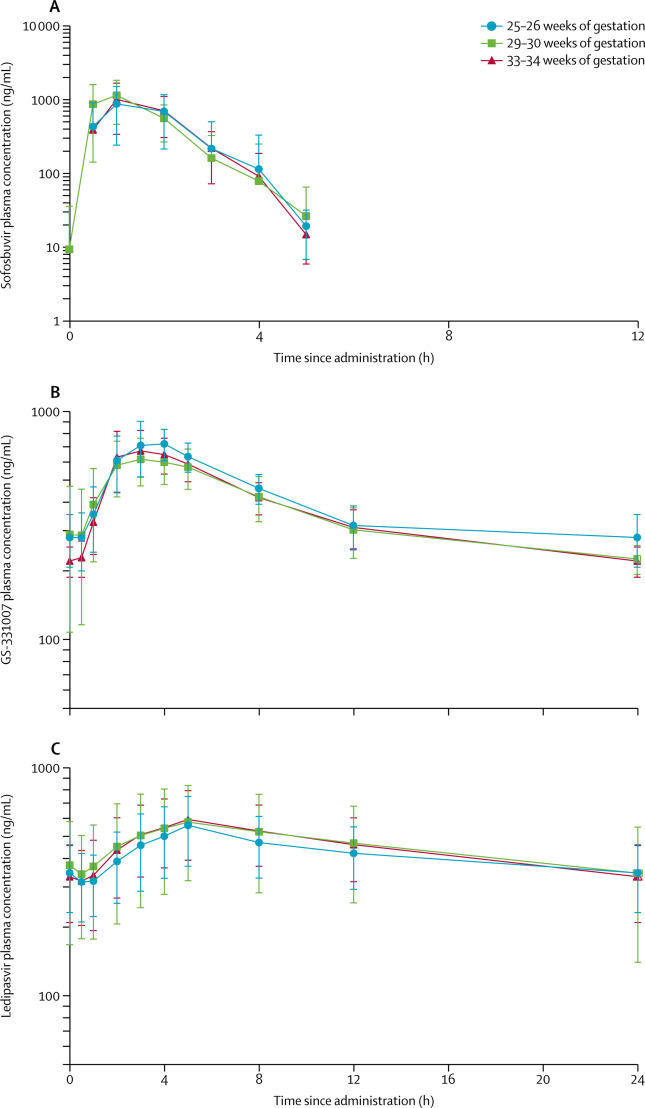
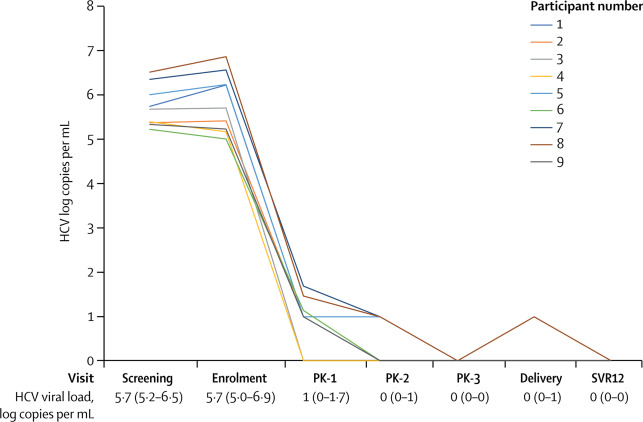
Las participantes se inscribieron entre las semanas 23 y 24 de embarazo, tuvieron un curso de 12 semanas de ledipasvir-sofosbuvir oral (90 mg diarios de ledipasvir más 400 mg de sofosbuvir). Se realizaron tres visitas donde se tomaron muestras de sangre (4 ml) antes de tomar el medicamento y a los 30 min, y 1, 2, 3, 4, 5, 8 y 12 horas, después de la dosis. Se tomó además 12 ml adicionales de sangre para el análisis de unión a proteínas. En cada visita se midió una carga viral de VHC y se evaluaron los eventos adversos.
Resultados
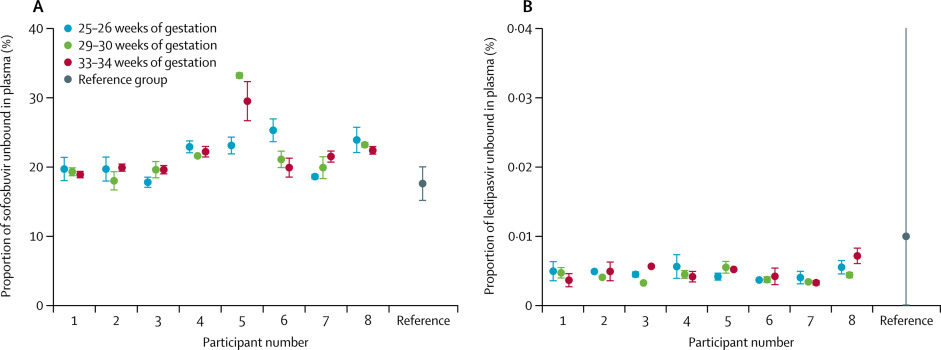
Durante el período de estudio se examinaron a 29 mujeres embarazadas con genotipo 1 y se inscribieron nueve (31%) a la investigación. Ocho (89%) mujeres fueron incluidas en el análisis primario. Las exposiciones a ledipasvir y sofosbuvir fueron similares en las mujeres embarazadas versus el grupo de referencia no gestante (proporción geométrica media de AUCtau de ledipasvir 89.3% [IC 90% 68.7–116.1]; sofosbuvir 91.1% [78.0 –106.3]) A las 12 semanas después del tratamiento, todas las participantes se curaron del VHC (100%), todos los lactantes fueron negativos al VHC (100%) y no se identificaron problemas de seguridad materna o neonatal.
Conclusión:
Ledipasvir-sofosbuvir fue seguro y efectivo sin diferencias clínicamente significativas en la exposición a medicamentos entre mujeres embarazadas y no embarazadas.
Comentario:
Este es el primer estudio clínico del tratamiento del VHC durante el embarazo con los antivirales de acción directa (ledipasvir-sofosbuvir).
Los datos de este estudio sugieren que la administración de ledipasvir-sofosbuvir a partir de las 23 semanas de gestación es seguro y efectivo para la cura del VHC. A pesar de estos resultados prometedores, se necesita un estudio de efectividad más amplio antes de que esta estrategia pueda recomendarse e incorporarse a la práctica clínica habitual. Además, en este estudio, el 34% de las mujeres embarazadas examinadas no eran elegibles para participar porque tenían infección por genotipo 2 o 3; por lo tanto, se debe considerar la evaluación de un esquema pangenotípico.
El Dr. Jorge Luis Poo, Hepatólogo Clínico, comenta que los estudios farmacológiccos se clasifican del 1 al 4. La fase 1 representa la primera exposición de un fármaco nuevo en el ser humano. En este caso, sería un Fase 1B, ya que el medicamento es conocido en el humano, pero nunca antes se había administrado en mujeres embarazadas. "Sin duda es un gran avance en el manejo de este subgrupo de pacientes y permite evitar que tengan que esperar a que termine el embarazo para recibir tratamiento, con la gran ventaja de que se evita el riesgo de infección del bebé, garantizando la seguridad de ambos y una gratísima eficacia del 100%. Enhorabuena para este gran estudio.
Referencia:
1. Catherine A Chappell, Kimberly K Scarsi, Brian J Kirby, PhD Vithika Suri, MSc Anuj Gaggar, Debra L Bogen, et al. Ledipasvir plus sofosbuvir in pregnant women with hepatitis C virus infection: a phase 1 pharmacokinetic study. The Lancet Microbe, published online: July 27 2020 DOI:https://doi.org/10.1016/S2666-5247(20)30062-8.


